22.2: Potenciales en Celdas Electroanalíticas
- Page ID
- 78719
Si un electrodo de Zn (s) en una solución de Zn 2 + (aq) en una celda electroquímica está en equilibrio, la corriente es cero y el potencial se fija en valor. Si cambiamos el potencial de su valor de equilibrio, la corriente fluirá a medida que el sistema se mueva a su nueva posición de equilibrio. Aunque la corriente inicial es bastante grande, disminuye con el tiempo, llegando a cero cuando la reacción alcanza el equilibrio. La corriente, por lo tanto, cambia en respuesta al potencial aplicado. Alternativamente, podemos pasar una corriente fija a través de la celda electroquímica, forzando la oxidación de Zn (s) a Zn 2 + (aq), efectuando un cambio en el potencial. En definitiva, si elegimos controlar el potencial, entonces debemos aceptar la corriente resultante, y debemos aceptar el potencial resultante si elegimos controlar la corriente.
La termodinámica de los potenciales celulares
Debido a que una reacción redox implica una transferencia de electrones de un agente reductor a un agente oxidante, es conveniente considerar la termodinámica de la reacción en términos del electrón. Para una reacción en la que un mol de un reactivo sufre oxidación o reducción, la transferencia neta de carga, q, en culombios es
\[q=n F \label{q} \]
donde n es los moles de electrones por mol de reactivo, y F es la constante de Faraday (96485 C/mol). La energía libre, ∆G, para mover esta carga dado un potencial aplicado, E, es
\[\Delta G=E q \label{deltaG1} \]
El cambio en la energía libre (en kJ/mol) para una reacción redox, por lo tanto, es
\[\Delta G=-n F E \label{deltaG2} \]
donde ∆G tiene unidades de kJ/mol. El signo menos en la Ecuación\ ref {delTag2} es el resultado de una convención diferente para asignar la dirección favorable de una reacción. En la termodinámica, se favorece una reacción cuando ∆G es negativa, pero se favorece una reacción redox cuando E es positiva. Sustituyendo la ecuación\ ref {deltaG2} en la ecuación termodinámica que relaciona la energía libre con su valor de estado estándar
\[\Delta G = \Delta G^{\circ} + RT\ln Q_r \label{deltaG3} \]
da
\[-n F E = -n F E^{\circ}+R T \ln Q_r \label{nfe} \]
Dividir por — nF conduce a la ecuación de Nernst
\[E=E^{\circ}-\frac{R T}{n F} \ln Q_r \label{nerst1} \]
donde E o es el potencial bajo condiciones de estado estándar (más sobre esto en la Sección 22.3). Sustituyendo los valores apropiados por R y F, asumiendo una temperatura de 25 o C (298 K), y cambiando del logaritmo natural (ln) al logaritmo base 10 (log) da el potencial en voltios como
\[E=E^{\mathrm{o}}-\frac{0.05916}{n} \log Q_r \label{nernst2} \]
El término\(Q_r\) en las ecuaciones anteriores es el cociente de reacción, que tiene la misma forma matemática que la expresión constante de equilibrio de la reacción, pero utiliza las cantidades instantáneas de reactivos y productos en lugar de sus valores de equilibrio. Para la celda de la Figura 22.1.1, por ejemplo, la reacción global es
\[\mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \rightleftharpoons 2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \label{net_rxn} \]
y Ecuación\ ref {nernst2} se convierte en
\[E = E^{\circ} - \frac{0.05916}{2} \log \frac {\left[ \ce{Zn^{2+}} \right]} {\left[ \ce{Ag+} \right]^2} \label{zn_ag} \]
La ecuación\ ref {zn_ag} nos muestra cómo cambia el potencial a medida que cambian las concentraciones de Zn 2 + y Ag +.
Como veremos en 22.3,\ ref {zn_ag} en realidad se expresa en términos de actividades en lugar de concentraciones. El apéndice del Capítulo 35.7 explica qué es la actividad, por qué es importante hacer una distinción entre actividad y concentración, y cuándo es razonable utilizar concentraciones en lugar de actividades.
Potenciales de unión líquida
Se desarrolla un potencial de unión en la interfaz entre dos soluciones iónicas si hay una diferencia en la concentración y la movilidad de los iones. Consideremos, por ejemplo, una membrana porosa que separa una solución de HCl 0.1 M de una solución de HCl 0.01 M (Figura\(\PageIndex{1}\) a). Debido a que la concentración de HCl en el lado izquierdo de la membrana es mayor que la del lado derecho de la membrana, H + y Cl — se difundirán en la dirección de las flechas. La movilidad de H +, sin embargo, es mayor que la de Cl —, como lo demuestra la diferencia en las longitudes de sus respectivas flechas. Debido a esta diferencia de movilidad, la solución en el lado derecho de la membrana desarrolla un exceso de concentración de H + y una carga positiva (Figura\(\PageIndex{1}\) b). Simultáneamente, la solución en el lado izquierdo de la membrana desarrolla una carga negativa debido a que hay un exceso de concentración de Cl —. Llamamos a esta diferencia de potencial a través de la membrana un potencial de unión y la representamos como E j.
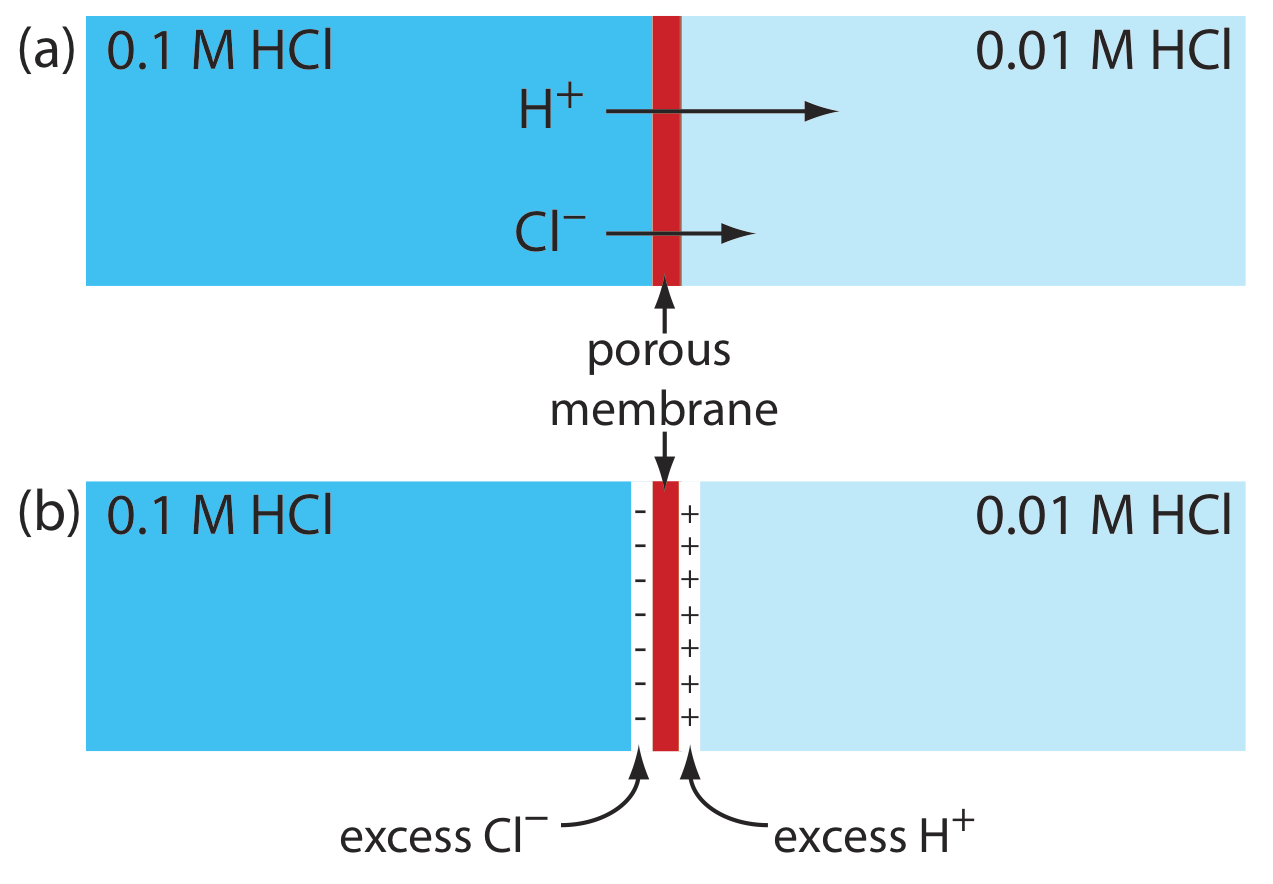
La magnitud de un potencial de unión depende de la diferencia en la concentración de iones en los dos lados de la interfaz, y puede ser tan grande como 30—40 mV. Por ejemplo, se ha medido un potencial de unión de 33.09 mV en la interfaz entre soluciones de HCl 0.1 M y NaCl 0.1 M [Sawyer, D. T.; Roberts, J. L., Jr. Electroquímica experimental para químicos, Wiley-Interscience: Nueva York, 1974, p. 22]. El potencial de unión de un puente salino se minimiza mediante el uso de una sal, como KCl, para la cual las movilidades del catión y anión son aproximadamente iguales. También podemos minimizar el potencial de unión incorporando una alta concentración de sal en el puente salino. Por esta razón, los puentes salinos se construyen frecuentemente usando soluciones que están saturadas con KCl. Sin embargo, siempre está presente un pequeño potencial de unión, generalmente de magnitud desconocida.


