22.5: Corrientes en Celdas Electroquímicas
- Page ID
- 78718
La mayoría de las técnicas electroquímicas se basan en controlar la corriente y medir el potencial resultante, o controlar el potencial y medir la corriente resultante; solo la potenciometría (ver Capítulo 23) mide un potencial en condiciones donde esencialmente no hay corriente. Comprender la relación entre la corriente, i, y el potencial, E, es importante. Aunque aprendimos en las Secciones 22.3 y 22.4 cómo calcular los potenciales de electrodo y los potenciales celulares usando la ecuación de Nernst, los potenciales medidos experimentalmente pueden diferir de sus valores termodinámicos por una variedad de razones que describimos aquí.
Gota de iR
El movimiento de una carga eléctrica en una celda electroquímica genera un potencial,\(E_{ir}\) definido por la ley de Ohm
\[E_{ir} = iR \label{ohm} \]
donde i es la corriente y R es la resistencia de la solución. Para dar cuenta de esto, podemos incluir un término adicional a la ecuación para el potencial de la celda electroquímica
\[E_\text{cell} = E_\text{cathode} - E_\text{anode} - E_{ir} = E_\text{Nernst} - iR \label{cellpot} \]
donde\(E_\text{Nernst}\) está el potencial de la ecuación de Nernst. La defunción resultante en el potencial de su valor idealizado se llama caída de iR.
Polarización
La ecuación\ ref {cellpot} indica que esperamos una relación lineal entre el potencial de una celda electroquímica,\(E_\text{cell}\). Cuando este no es el caso, se dice que la celda electroquímica está polarizada. Existen varias fuentes que contribuyen a la polarización, que consideramos en esta sección; primero, sin embargo, definimos electrodos ideales polarizados y no polarizados.
Electrodos ideales polarizados y no polarizados y celdas electroquímicas
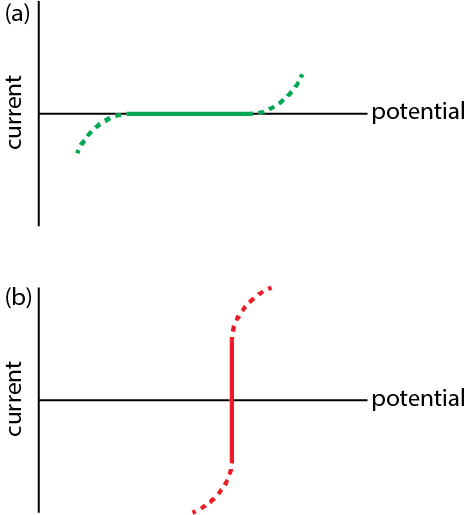
Un electrodo polarizado ideal es aquel en el que un cambio de potencial en un rango bastante amplio no tiene efecto sobre la corriente que fluye a través del electrodo, como vemos en la Figura\(\PageIndex{1}a\) para el rango de potenciales definido por la línea verde continua. Dichos electrodos son útiles porque ellos mismos no sufren oxidación o reducción, son electroquímicamente inertes, lo que los convierte en una buena opción para estudiar el comportamiento electroquímico de otras especies.
Un electrodo ideal no polarizado es aquel en el que un cambio en la corriente no tiene efecto sobre el potencial del electrodo, como vemos en la Figura\(\PageIndex{1}b\) entre los límites definidos por la línea roja continua con desviaciones mostradas por la línea roja discontinua. Dichos electrodos son útiles porque proporcionaron un potencial estable contra el cual podemos hacer referencia al potencial redox de otras especies.
Sobrepotencial
La magnitud de polarización al dibujar una corriente se denomina sobrepotencial,\(\eta\) y se expresa como la diferencia entre el potencial aplicado, E, y el potencial de la ecuación de Nernst.
\[\eta = E - E_\text{Nernst} \label{overpot} \]
El sobrepotencial se puede subdividir en una variedad de fuentes, algunas de las cuales se discuten a continuación.
Polarización de concentración
La reducción de Fe 3 + a Fe 2 + en una celda electroquímica consume un electrón, el cual se extrae del electrodo. La oxidación de otra especie, tal vez el disolvente, en un segundo electrodo es la fuente de este electrón. Debido a que la reducción de Fe 3 + a Fe 2 + consume un electrón, el flujo de electrones entre los electrodos, es decir, la corriente, es una medida de la velocidad a la que se reduce Fe 3 +.
La velocidad de reacción\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\) es el cambio en la concentración de Fe 3 + en función del tiempo.
Para que se produzca la reducción de Fe 3 + a Fe 2 +, el Fe 3 + debe pasar de la solución a granel a la capa de solución inmediatamente adyacente al electrodo y luego difundirse a la superficie del electrodo; esto se denomina capa de difusión. Una vez que se produce la reducción, el Fe 2 + producido debe difundirse lejos de la superficie del electrodo y entrar en la solución a granel. Estos dos procesos se denominan transferencia de masa y si tratamos de cambiar el potencial del electrodo demasiado rápido, la transferencia de masa puede resultar en concentraciones de Fe 3 + a Fe 2 + en la superficie del electrodo que son diferentes de las de la solución a granel, resultando en polarización de concentración.
Usemos la reducción de Fe 3 + a Fe 2 + en el cátodo de una celda galvánica para pensar cómo la polarización de concentración afecta el potencial que medimos. De la ecuación de Nernst sabemos que
\[E = E_{\ce{Fe^{3+}}/\ce{Fe^{2+}}}^{\circ} - \frac {0.05916} {1} \log \frac {[\ce{Fe^{2+}}]}{[\ce{Fe^{3+}}]} = +0.771 - \frac {0.05916} {1} \log \frac {[\ce{Fe^{2+}}]}{[\ce{Fe^{3+}}]} \label{iron1} \]
Si la transferencia de masa de Fe 3 + de la solución a granel a la superficie del electrodo es lenta y si la transferencia de masa de Fe 2 + de la superficie del electrodo a la solución a granel es lenta, entonces la concentración de Fe 3 + en la superficie del electrodo es menor que en la solución a granel y la concentración de Fe 2 + en la superficie del electrodo es mayor que en la solución a granel. Como resultado, la relación\(\frac {[\ce{Fe^{2+}}]}{[\ce{Fe^{3+}}]}\) es mayor que la predicha por las concentraciones masivas de Fe 3 + y Fe 2 + y el potencial del cátodo es menor (menos positivo) que el valor +0.771 V predicho por las concentraciones masivas de Fe 3 + y Fe 2 +. El potencial resultante de la celda electroquímica
\[E_\text{cell} = E_\text{cathode} - E_\text{anode} \label{iron2} \]
es menos positiva que la pronosticada por las concentraciones masivas de Fe 3 + y Fe 2 + debido a esta polarización de concentración.
Otros procesos cinéticos pueden contribuir a la polarización, incluyendo la velocidad de reacciones químicas que tienen lugar dentro de la capa de solución cerca de la superficie del electrodo, la cinética de reacciones en las que las especies electroactivas absorben o desorben de la superficie del electrodo, y la cinética del electrón proceso de transferencia en sí. Más detalles sobre estos se incluyen en capítulos posteriores que cubren técnicas electroquímicas específicas.


