23.1: Electrodos de Referencia
- Page ID
- 78975
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)En potenciometría medimos la diferencia entre el potencial de dos electrodos. El potencial de un electrodo, el electrodo de trabajo o indicador, responde a la actividad del analito y el otro electrodo, el contador o electrodo de referencia, tiene un potencial fijo conocido. Por convención, el electrodo de referencia es el ánodo; así, la notación manual corta para una celda electroquímica potenciométrica es
electrodo de referencia || electrodo indicador
y el potencial celular es
\[E_{\mathrm{cell}}=E_{\mathrm{ind}}-E_{\mathrm{ref}} \nonumber \]
El electrodo de referencia ideal proporciona un potencial estable y conocido para que podamos atribuir cualquier cambio en la celda E al efecto del analito sobre el potencial del electrodo indicador. Además, el electrodo de referencia debe ser fácil de hacer y fácil de usar. Aunque el electrodo de hidrógeno estándar es el electrodo de referencia utilizado para definir los potenciales de los electrodos, su uso no es común. En cambio, los dos electrodos de referencia discutidos en esta sección encuentran la mayor cantidad de aplicaciones.
Electrodos de Calomelanos
Un electrodo de referencia de calomelanos se basa en el siguiente par redox entre Hg 2 Cl 2 y Hg (calomel es el nombre común para Hg 2 Cl 2)
\[\mathrm{Hg}_{2} \mathrm{Cl}_{2}(s)+2 e^{-}\rightleftharpoons2 \mathrm{Hg}(l)+2 \mathrm{Cl}^{-}(a q) \nonumber \]
para lo cual el potencial es
\[E=E_{\mathrm{Hg}_{2} \mathrm{Cl}_{2} / \mathrm{Hg}}^{\mathrm{o}}-\frac{0.05916}{2} \log \left(a_{\text{Cl}^-}\right)^{2}=+0.2682 \mathrm{V}-\frac{0.05916}{2} \log \left(a_{\text{Cl}^-}\right)^{2} \nonumber \]
El potencial de un electrodo de calomelanos, por lo tanto, depende de la actividad de Cl —en equilibrio con Hg y Hg 2 Cl 2.
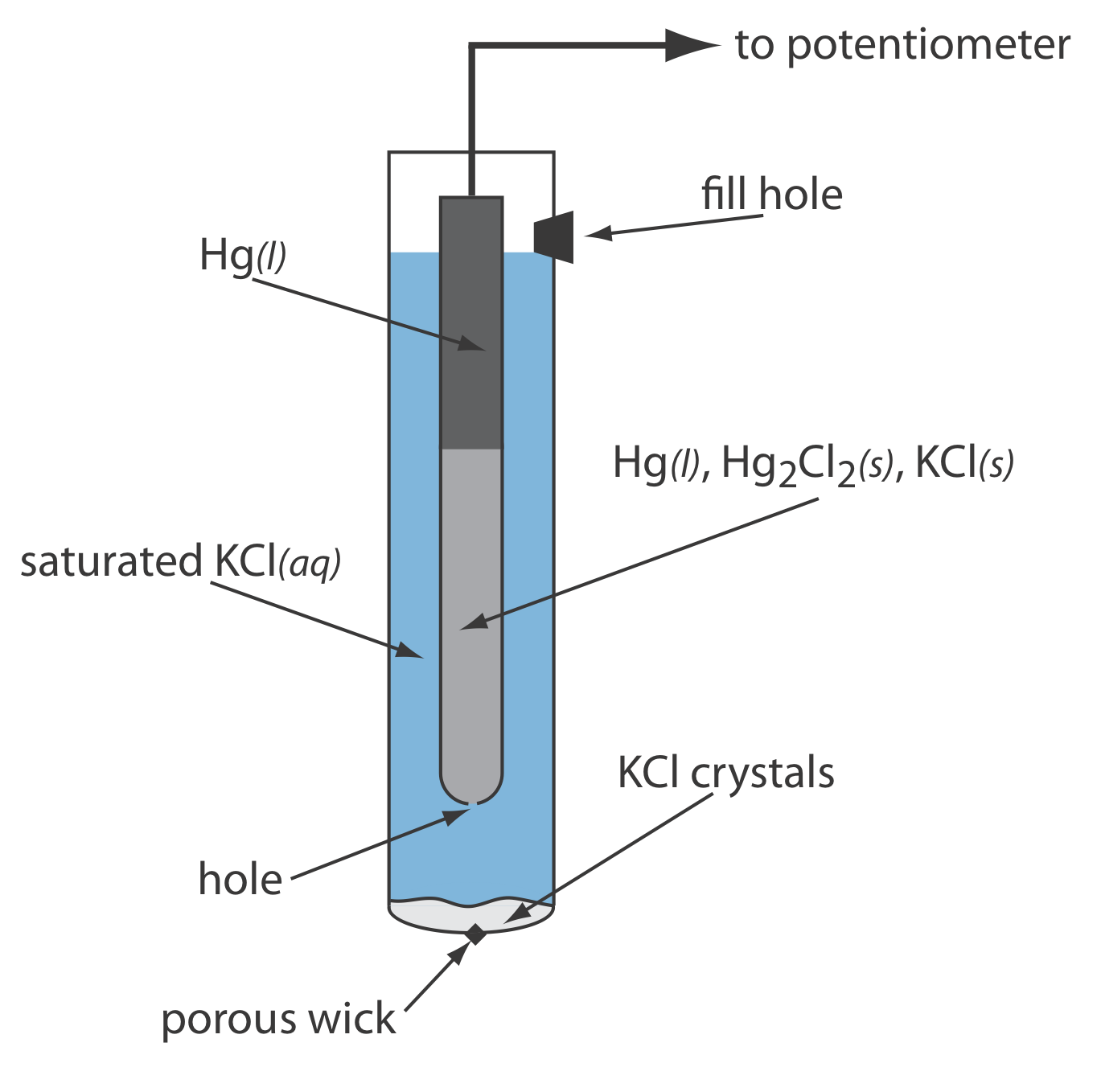
Como se muestra en la Figura\(\PageIndex{1}\), en un electrodo de calomelano saturado (SCE) la concentración de Cl — está determinada por la solubilidad de KCl. El electrodo consiste en un tubo interno empaquetado con una pasta de Hg, Hg 2 Cl 2 y KCl, situado dentro de un segundo tubo que contiene una solución saturada de KCl. Un pequeño orificio conecta los dos tubos y una mecha porosa sirve como puente salino a la solución en la que se sumerge el SCE. Un tapón en el tubo exterior proporciona una abertura para agregar KCl saturado de adición. La notación de mano corta para esta celda es
\[\mathrm{Hg}(l) | \mathrm{Hg}_{2} \mathrm{Cl}_{2}(s), \mathrm{KCl}(a q, \text { sat'd }) \| \nonumber \]
Debido a que la concentración de Cl — se fija por la solubilidad de KCl, el potencial de un SCE permanece constante aunque perdamos parte de la solución interna por evaporación. Una desventaja significativa del SCE es que la solubilidad del KCl es sensible a un cambio de temperatura. A temperaturas más altas la solubilidad de KCl aumenta y el potencial del electrodo disminuye. Por ejemplo, el potencial del SCE es +0.2444 V a 25 o C y +0.2376 V a 35 o C. El potencial de un electrodo de calomelanos que contiene una solución insaturada de KCl es menos dependiente de la temperatura, pero su potencial cambia si la concentración, y por lo tanto la actividad de Cl —, aumenta debido a la evaporación.
Por ejemplo, el potencial de un electrodo de calomelanos es +0.280 V cuando la concentración de KCl es 1.00 M y +0.336 V cuando la concentración de KCl es 0.100 M. Si la actividad de Cl — es 1.00, el potencial es +0.2682 V.
Electrodos de Plata/Cloruro de Plata
Otro electrodo de referencia común es el electrodo de plata/cloruro de plata, que se basa en la reducción de AgCl a Ag.
\[\operatorname{AgCl}(s)+e^{-} \rightleftharpoons \mathrm{Ag}(s)+\mathrm{Cl}^{-}(a q) \nonumber \]
Como es el caso del electrodo de calomelanos, la actividad de Cl — determina el potencial del electrodo de Ag/AgCl; así
\[E = E_\text{AgCl/Ag}^{\circ}-0.05916 \log a_{\text{Cl}^-} = 0.2223 \text{ V} - 0.05916 \log a_{\text{Cl}^-} \nonumber \]
Cuando se prepara usando una solución saturada de KCl, el potencial del electrodo es +0.197 V a 25 o C. Otro electrodo común de Ag/AgCl utiliza una solución de KCl 3.5 M y tiene un potencial de +0.205 V a 25 o C. Como es de esperar, el potencial de un electrodo de Ag/AgCl usando una solución saturada de El KCl es más sensible a un cambio de temperatura que un electrodo que utiliza una solución insaturada de KCl.
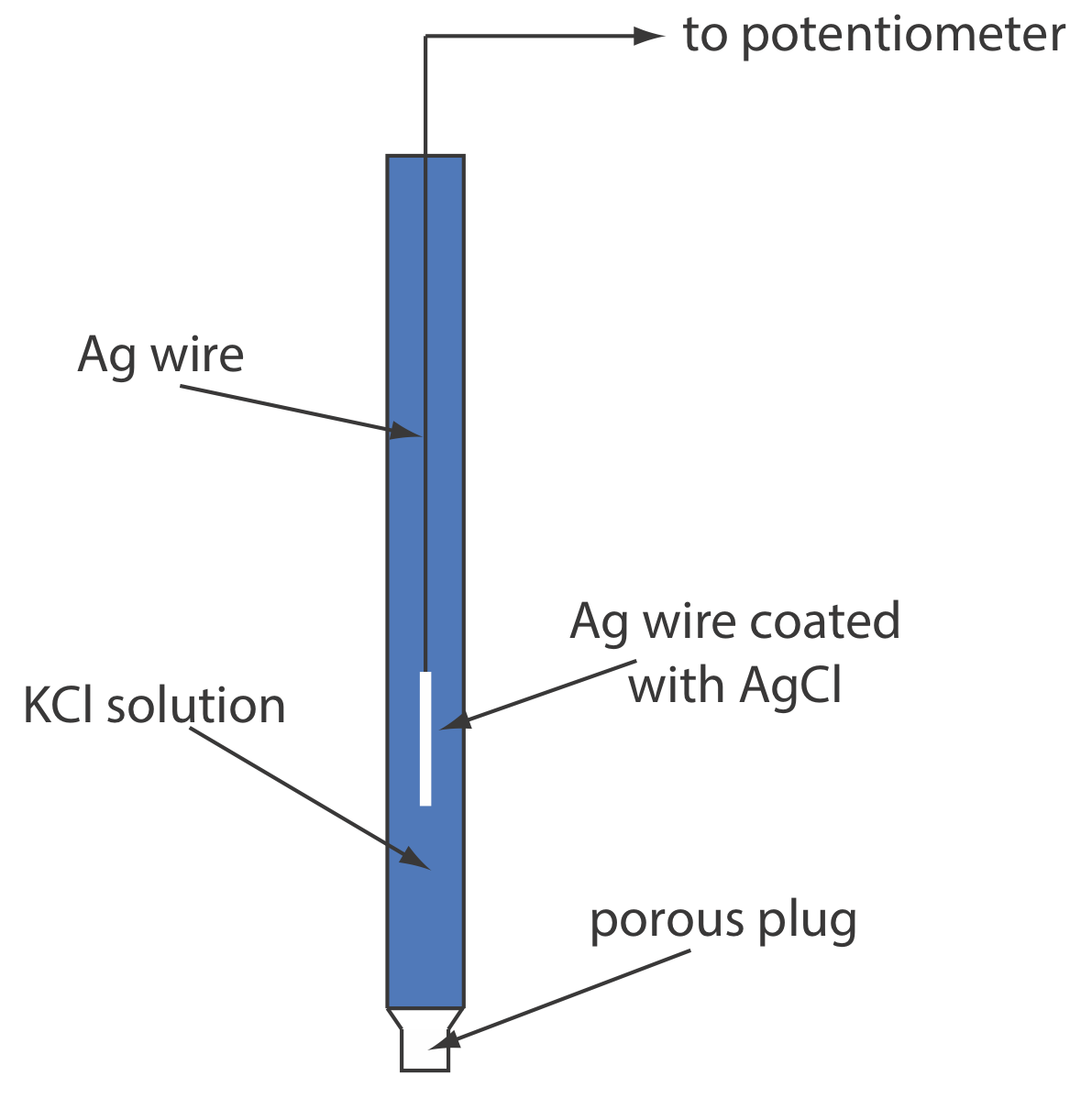
Un electrodo típico de Ag/AgCl se muestra en la Figura\(\PageIndex{2}\) y consiste en un alambre de plata, cuyo extremo está recubierto con una película delgada de AgCl, sumergido en una solución que contiene la concentración deseada de KCl. Un tapón poroso sirve como puente de sal. La notación de mano corta del electrodo es
\[\operatorname{Ag}(s) | \operatorname{Ag} \mathrm{Cl}(s), \mathrm{KCl}\left(a q, a_{\mathrm{Cl}^{-}}=x\right) \| \nonumber \]
Conversión de potenciales entre electrodos de referencia
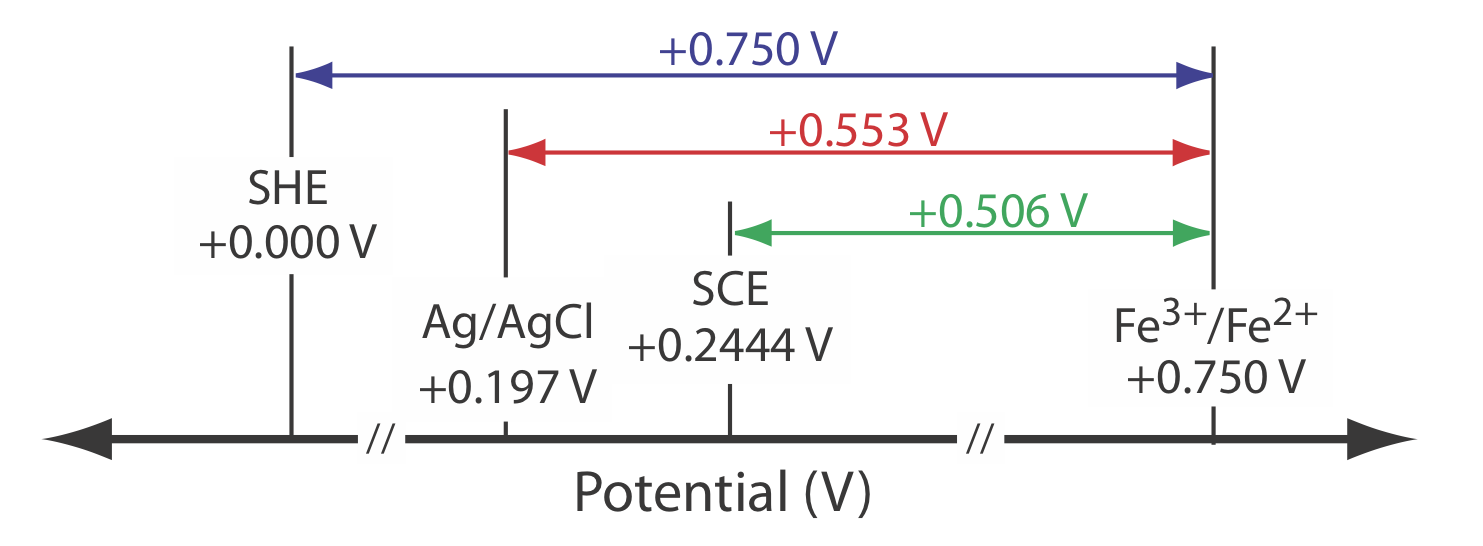
Los potenciales de reducción de estado estándar en la mayoría de las tablas se reportan en relación con el potencial del electrodo de hidrógeno estándar de +0.00 V. Debido a que rara vez usamos el SHE como electrodo de referencia, necesitamos convertir el potencial de un electrodo indicador a su valor equivalente cuando se usa un electrodo de referencia diferente. Como se muestra en el siguiente ejemplo, esto es fácil de hacer.
El potencial para una media celda de Fe 3 + /Fe 2 + es de +0.750 V en relación con el electrodo de hidrógeno estándar. ¿Cuál es su potencial si usamos un electrodo de calomelano saturado o un electrodo saturado de plata/cloruro de plata?
Solución
Cuando usamos un electrodo de hidrógeno estándar, el potencial de la celda electroquímica es
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.000 \text{ V} = 0.750 \text{ V} \nonumber \]
Podemos usar la misma ecuación para calcular el potencial si usamos un electrodo de calomelano saturado
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.2444 \text{ V} = 0.506 \text{ V} \nonumber \]
o un electrodo saturado de plata/cloruro de plata
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.197 \text{ V} = 0.553 \text{ V} \nonumber \]
La figura\(\PageIndex{3}\) proporciona una representación pictórica de la relación entre estos diferentes potenciales.