23.2: Electrodos indicadores metálicos
( \newcommand{\kernel}{\mathrm{null}\,}\)
En potenciometría, el potencial del electrodo indicador es proporcional a la actividad del analito. Se utilizan dos clases de electrodos indicadores para realizar mediciones potenciométricas: electrodos metálicos, que son objeto de esta sección, y electrodos selectivos de iones, los cuales se cubren en la siguiente sección.
Electrodos de Primera Clase
Si colocamos un electrodo de cobre en una solución que contiene Cu 2 +, el potencial del electrodo debido a la reacción
Cu2+(aq)+2e−⇌Cu(s)
se determina por la actividad de Cu 2 +.
E=EoCu2+/Cu−0.059162log1aCu2+=+0.3419V−0.059162log1aCu2+
Si el cobre es el electrodo indicador en una celda electroquímica potenciométrica que también incluye un electrodo de referencia de calomelanos saturado
SCE‖Cu2+(aq,aCu2+=x)|Cu(s)
entonces podemos usar el potencial celular para determinar una actividad desconocida de Cu 2 + en la semicelda del electrodo indicador
Ecell=E ind −ESCE =+0.3419V−0.059162log1aCu2+−0.2224V
Un electrodo indicador en el que el metal está en contacto con una solución que contiene su ion se denomina electrodo de primer tipo. En general, si un metal, M, está en una solución de Mn+, el potencial celular es
Ecall=K−0.05916nlog1aMn+=K+0.05916nlogaMn+
donde K es una constante que incluye el potencial de estado estándar para el par redox Mn+/M y el potencial del electrodo de referencia.
Por una variedad de razones, incluyendo la cinética lenta de transferencia de electrones en la interfaz metal—solución, la formación de óxidos metálicos en la superficie del electrodo y las reacciones interferentes, los electrodos del primer tipo se limitan a los siguientes metales: Ag, Bi, Cd, Cu, Hg, Pb, Sn, Tl y Zn.
Muchos de estos electrodos, como el Zn, no pueden ser utilizados en soluciones ácidas porque son fácilmente oxidados por H +.
Zn(s)+2H+(aq)⇌ H2(g)+Zn2+(aq)
Electrodos de la Segunda Clase
El potencial de un electrodo de primer tipo responde a la actividad de M n +. También podemos utilizar este electrodo para determinar la actividad de otra especie si está en equilibrio con M n +. Por ejemplo, el potencial de un electrodo de Ag en una solución de Ag + es
E=0.7996V+0.05916logaAg+
Si saturamos la semicelda del electrodo indicador con AGi, la reacción de solubilidad
Agl(s)⇌Ag+(aq)+I−(aq)
determina la concentración de Ag +; así
aAg+=Ksp,AglaI−
donde K sp, AGi es el producto de solubilidad para AGi. Sustituyendo la ecuación\ ref {second3} en la ecuación\ ref {second1}
E=0.7996 V+0.05916logKsp, AglaI−
muestra que el potencial del electrodo de plata es una función de la actividad de I —. Si incorporamos este electrodo en una celda electroquímica potenciométrica con un electrodo de calomelano saturado
SCE‖AgI(s), I−(aq,aI−=x)|Ag(s)
entonces el potencial celular es
Ecell=K−0.05916logaI−
donde K es una constante que incluye el potencial de estado estándar para el par redox Ag + /Ag, el producto de solubilidad para AGi y el potencial del electrodo de referencia.
Si un electrodo de primer tipo responde a la actividad de un ion en equilibrio con M n +, lo llamamos electrodo de segundo tipo. Dos electrodos comunes del segundo tipo son el calomel y los electrodos de referencia plata/cloruro de plata.
En un electrodo del segundo tipo enlazamos una reacción redox y otra reacción, como una reacción de solubilidad. Quizás te preguntes si podemos vincular más de dos reacciones. La respuesta corta es sí. Un electrodo de tercer tipo, por ejemplo, une una reacción redox y otras dos reacciones. Dichos electrodos son menos comunes y no los consideraremos en este texto.
Electrodos Redox Metálicos
Un electrodo del primer tipo o del segundo tipo desarrolla un potencial como resultado de una reacción redox que involucra al electrodo metálico. Un electrodo también puede servir como fuente de electrones o como sumidero de electrones en una reacción redox no relacionada, en cuyo caso lo llamamos electrodo redox. El cátodo de Pt23.2.1 es un electrodo redox debido a que su potencial está determinado por la actividad de Fe 2 + y Fe 3 + en la semicelda indicadora. Tenga en cuenta que el potencial de un electrodo redox a menudo responde a la actividad de más de un ion, lo que limita su utilidad para la potenciometría directa.
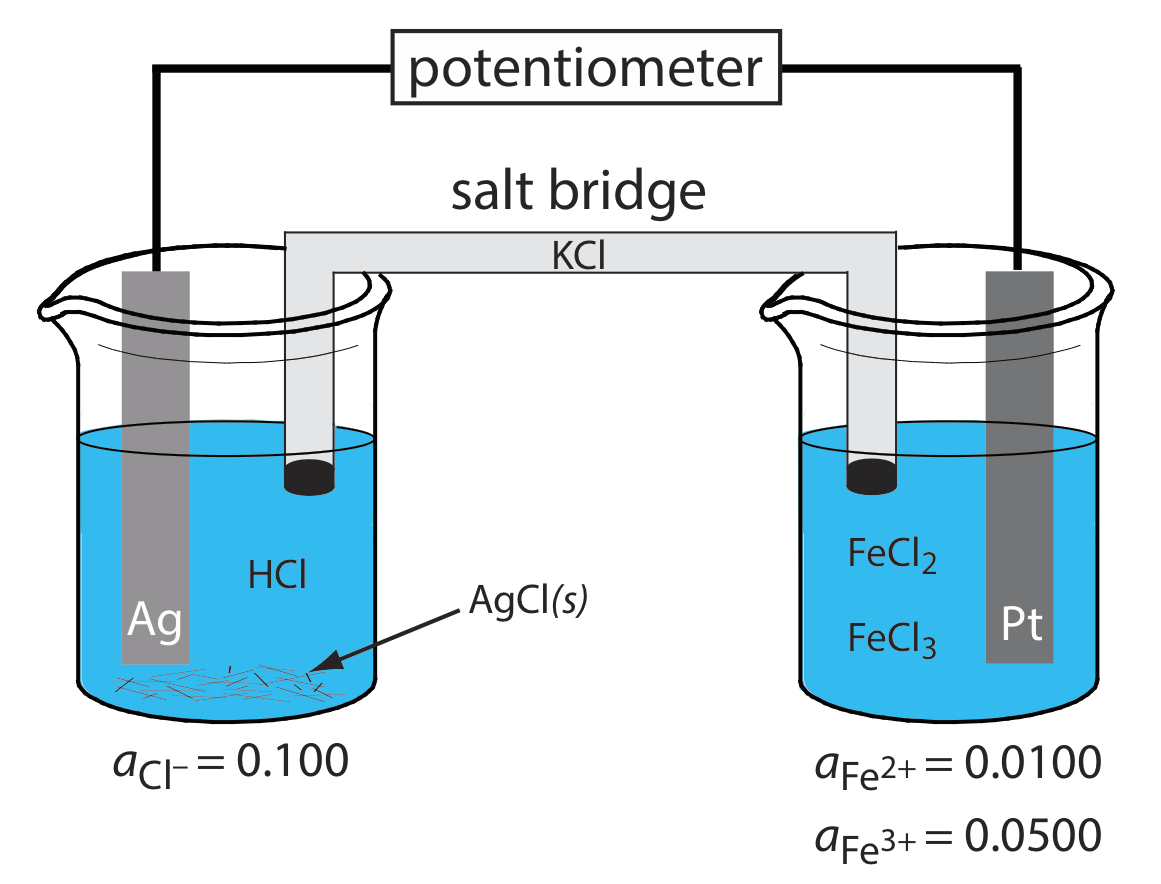
Figura23.2.1. Celda electroquímica potenciométrica en la que el ánodo es un electrodo metálico de primer tipo (Ag) y el cátodo es un electrodo redox metálico (Pt).


