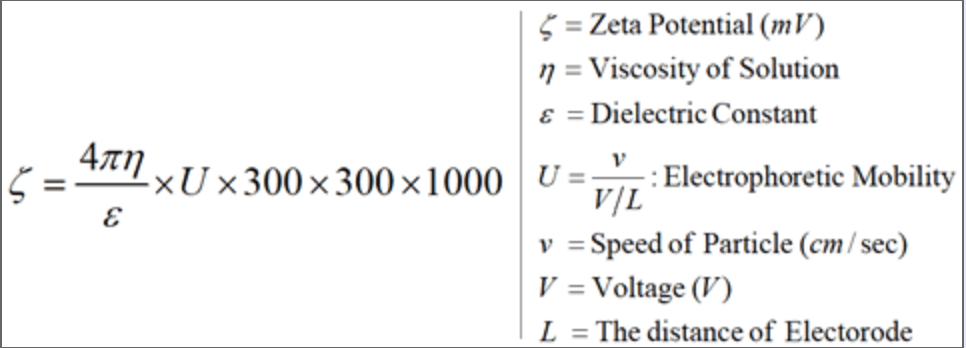2.5: Análisis de Potencial Zeta
- Page ID
- 71166
Introducción
Las propiedades físicas de los coloides (nanopartículas) y suspensiones dependen fuertemente de la naturaleza y extensión de la interfaz partícula-líquido. El comportamiento de las dispersiones acuosas entre partículas y líquido es especialmente sensible a la estructura iónica y eléctrica de la interfaz.
El potencial zeta es un parámetro que mide el equilibrio electroquímico en la interfaz partícula-líquido. Mide la magnitud de la repulsión/atracción electrostática entre partículas y así, se ha convertido en uno de los parámetros fundamentales conocidos por afectar la estabilidad de las partículas coloidales. Cabe señalar que ese término estabilidad, cuando se aplica a dispersiones coloidales, generalmente significa la resistencia al cambio de la dispersión con el tiempo. La figura\(\PageIndex{1}\) ilustra el concepto básico de potencial zeta.
Desde la perspectiva de la teoría fundamental, el potencial zeta es el potencial eléctrico en la doble capa interfacial (DL) en la ubicación del plano de deslizamiento (mostrado en la Figura\(\PageIndex{1}\)). Podemos considerar el potencial zeta como la diferencia de potencial entre el medio de dispersión y la capa estacionaria del fluido unido a la capa de partículas. Por lo tanto, en preocupaciones experimentales, el potencial zeta es un factor clave en procesos como la preparación de dispersiones coloidales, la utilización de fenómenos coloidales y la destrucción de dispersiones coloidales no deseadas. Además, el análisis y las mediciones de potencial zeta hoy en día tienen muchas aplicaciones en el mundo real. En el campo de la investigación biomédica, la medición del potencial zeta, en contraste con los métodos químicos de análisis que pueden perturbar el organismo, tiene el mérito particular de proporcionar información referente a las regiones más externas de un organismo. También se utiliza en gran medida en la purificación y tratamiento de agua. El análisis de potencial Zeta ha establecido condiciones óptimas de coagulación para la eliminación de materia particulada y colorantes orgánicos de productos de desecho acuosos.
Breve historia y desarrollo del potencial zeta
El potencial zeta es un término científico para el potencial electrocinético en dispersiones coloidales. En la literatura anterior, se suele denotar usando la letra griega zeta,, de ahí que haya obtenido el nombre potencial zeta como -potencial. La teoría más temprana para calcular el potencial Zeta a partir de datos experimentales fue desarrollada por Marian Smoluchowski en 1903 (Figura\(\PageIndex{2}\)). Incluso hasta hoy, esta teoría sigue siendo el método más conocido y ampliamente utilizado para calcular el potencial zeta.

Curiosamente, esta teoría fue desarrollada originalmente para electroforesis. Posteriormente, la gente empezó a aplicar su teoría en el cálculo del potencial zeta. La razón principal por la que esta teoría es poderosa es por su universalidad y validez para partículas dispersas de cualquier forma y cualquier concentración. Sin embargo, aún existen algunas limitaciones a esta teoría temprana ya que se determinó principalmente de manera experimental. Las principales limitaciones son que la teoría de Smoluchowski descuida la contribución de la conductividad superficial y solo funciona para partículas que tienen tamaños mucho mayores que la capa de interfaz, denotada como κ a (1/κ se llama longitud de Debye y a es el radio de partícula).
Overbeek y Booth como pioneros en esta dirección comenzaron a desarrollar teorías electrocinéticas más teóricas y rigurosas que fueron capaces de incorporar conductividad superficial para aplicaciones electrocinéticas. Las teorías electrocinéticas rigurosas modernas que son válidas casi cualquier κa en su mayoría se generan a partir de científicos ucranianos (Dukhin) y australianos (O'Brien).
Principio de Análisis de Potencial Zeta
Fenómenos electrocinéticos
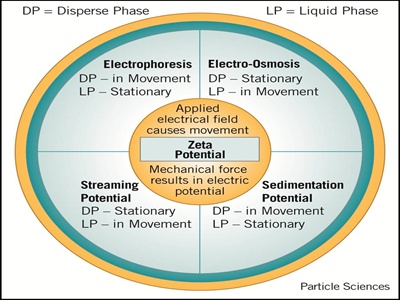
Debido a que existe una doble capa eléctrica (EDL) entre una superficie y una solución, entonces cualquier movimiento relativo entre las partes rígidas y móviles de la EDL dará como resultado la generación de un potencial electrocinético. Como se describió anteriormente, el potencial zeta es esencialmente un potencial electrocinético que se eleva a partir de fenómenos electrocinéticos. Por lo que es importante entender diferentes situaciones donde se pueda producir potencial electrocinético. En general, hay cuatro formas fundamentales en las que se puede producir el potencial zeta, a través de electroforesis, electroósmosis, potencial de flujo y potencial de sedimentación, como se muestra en la Figura\(\PageIndex{3}\).
Cálculos del Potencial Zeta
Hay muchas formas diferentes de calcular el potencial zeta. En esta sección se introducirán los métodos de cálculo del potencial zeta en electroforesis y electroósmosis.
Potencial Zeta en Electroforesis
La electroforesis es el movimiento de partículas coloidales cargadas o polielectrolitos, sumergidos en un líquido, bajo la influencia de un campo eléctrico externo. En tal caso, la velocidad electroforética, v e (ms -1) es la velocidad durante la electroforesis y la movilidad electroforética, u e (m 2 V -1 s -1) es la magnitud de la velocidad dividida por la magnitud del campo eléctrico fuerza. La movilidad se cuenta positiva si las partículas se mueven hacia un menor potencial y negativo en el caso contrario. Y por lo tanto, tenemos la relación v e = u e E, donde E es el campo aplicado externamente.
Así, la fórmula contabilizada para el potencial zeta en caso de electroforesis se da en EQ, donde ε rs es la permitividad relativa de la solución electrolítica, ε 0 es la permitividad eléctrica de vacío y η es la viscosidad.
\[ \mathit{u}_{e}\ =\frac{\varepsilon _{rs} \varepsilon_{0} \zeta}{\eta } \label{1} \]
\[ \mathit{v}_{e}\ =\frac{\varepsilon _{rs} \varepsilon_{0} \zeta}{\eta } E \label{2} \]
Hay dos casos con respecto al tamaño de κa:
- κa < 1: la fórmula es similar,\ ref {3}.
- κa > 1: la fórmula es bastante complicada y necesitamos resolver la ecuación para el potencial zeta,\ ref {4}, donde\( y^{e \zeta}=\ e\zeta /kT \), m es aproximadamente 0.15 para solución acuosa.
\[ \mathit{u}_{e} = \frac{2}{3} \frac{\varepsilon _{rs} \varepsilon_{0} \zeta}{\eta } \label{3} \]
\[ \frac{3}{2}\frac{\eta e}{\varepsilon _{rs} \varepsilon _{0}kT} \mathit{u_{e}} =\frac{3}{2}y^{ek} -\frac{6[\frac{y^{ek}}{2}-\frac{ln\ 2}{\zeta}\{1-e^{-\zeta y^{ek}}\}]}{2+ \frac{ka}{1+3m/\zeta ^{2}}e^{\frac{-\zeta y^{ek}}{2}}} \label{4} \]
Potencial Zeta en Electroósmosis
La electroósmosis es el movimiento de un líquido a través de un conjunto inmovilizado de partículas, un tapón poroso, un capilar o una membrana, en respuesta a un campo eléctrico aplicado. Similar a la electroforesis, tiene la velocidad electroosmótica, v eo (ms -1) como la velocidad uniforme del líquido lejos de la interfaz cargada. Por lo general, la cantidad medida es el caudal volumétrico de líquido dividido por la intensidad del campo eléctrico, Q eo, E (m 4 V -1 s -1) o sumergido por la corriente eléctrica, Q eo, I (m 3 C -1). Por lo tanto, la relación viene dada por\ ref {5}.
\[ Q_{eo} =\ \int \int v_{eo} dS \label{5} \]
Así, la fórmula contabilizada para el potencial Zeta en la electroósmosis se da en EQ.
Al igual que con la electroforesis hay dos casos respecto al tamaño de κa:
- κa >>1 y no hay conducción superficial, donde Ac es el área de sección transversal y KL es la conductividad aparente de la partícula.
- κa < 1,\ ref {6}, donde\(\Delta u \ =\frac{K^{\sigma }}{K_{L}} \) es la cuenta del número Dukhin para la conductividad superficial,\( K^{\sigma} \) es la conductividad superficial de la partícula.
\[ Q_{eo , E} =\frac{-\varepsilon _{rs} \varepsilon_{0} \zeta }{\eta} Ac \nonumber \]
\[ Q_{eo , I} =\frac{-\varepsilon _{rs} \varepsilon_{0} \zeta }{\eta} \frac{1}{K_{L}} \nonumber \]
\[ Q_{eo , I} =\frac{-\varepsilon _{rs} \varepsilon_{0} \zeta }{\eta} \frac{1}{K_{L}(1+2\Delta u)} \label{6} \]
Relación entre el potencial Zeta y la estabilidad de partículas en electroforesis
Usando los métodos teóricos anteriores, podemos calcular el potencial zeta para partículas en electroforesis. En la siguiente tabla se resume el comportamiento de estabilidad de las partículas coloidales con respecto al potencial zeta. Así, podemos utilizar el potencial zeta para predecir la estabilidad de las partículas coloidales en los fenómenos electrocinéticos de la electroforesis.
| Potencial Zeta (mV) | Comportamiento de estabilidad de las partículas |
| 0 a ±5 | Coagulación rápida o floculación |
| ±10 a ±30 | Inestabilidad incipiente |
| ±30 a ±40 | Estabilidad moderada |
| ±40 a ±60 | Buena Estabilidad |
| Más de ±61 | Excelente estabilidad |
Instrumentación
En esta sección, se utilizará un analizador de potencial zeta disponible en el mercado como ejemplo de cómo se analiza experimentalmente el potencial zeta. La figura\(\PageIndex{4}\) muestra un ejemplo de un analizador de potencial zeta típico para electroforesis.

El principio de medición interior se describe en el siguiente diagrama, que muestra el mecanismo detallado del analizador de potencial zeta (Figura\(\PageIndex{5}\)).
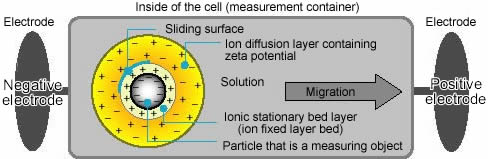
Cuando se aplica un voltaje a la solución en la que se dispersan las partículas, las partículas son atraídas hacia el electrodo de polaridad opuesta, acompañadas por la capa fija y parte de la doble capa difusa, o lado interno de la “superficie deslizante”. Usando la siguiente fórmula a continuación de este Analizador específico y el programa de computadora, podemos obtener el potencial zeta para electroforesis usando este analizador de potencial zeta típico (Figura\(\PageIndex{6}\).