3.1: Ionización de electrones
- Page ID
- 77728
Ionización de electrones
La ionización electrónica (EI) es la técnica de ionización más común utilizada para la espectrometría de masas. * EI funciona bien para muchas moléculas en fase gaseosa, pero tiene algunas limitaciones. Aunque los espectros de masas son muy reproducibles y son ampliamente utilizados para bibliotecas espectrales, EI provoca una fragmentación extensa por lo que el ión molecular no se observa para muchos compuestos. La fragmentación es útil porque proporciona información estructural para interpretar espectros desconocidos. Los patrones de fragmentación se discuten con más detalle en el capítulo de Interpretación.
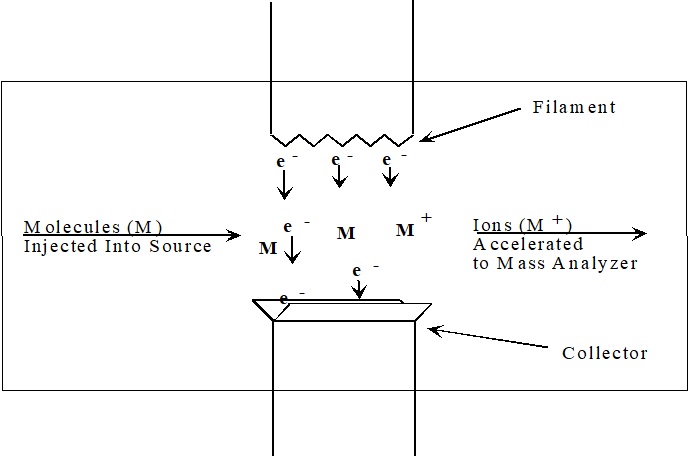
Figura\(\PageIndex{1}\): Fuente de ionización de electrones
Los electrones utilizados para la ionización se producen haciendo pasar una corriente a través de un filamento de alambre (Figura\(\PageIndex{1}\)). La cantidad de corriente controla el número de electrones emitidos por el filamento. Un campo eléctrico acelera estos electrones a través de la región fuente para producir un haz de electrones de alta energía. Cuando una molécula de analito pasa a través de este haz de electrones, un electrón de capa de valencia se puede eliminar de la molécula para producir un ion.
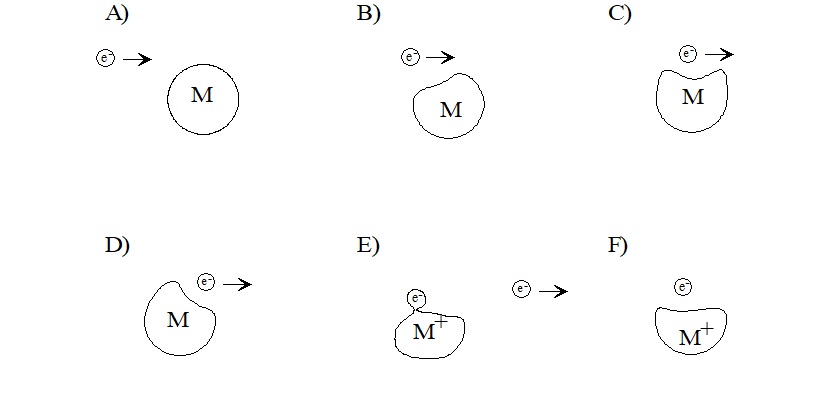
La ionización no ocurre por captura de electrones, la cual es altamente dependiente de la estructura molecular. En cambio, EI produce iones positivos al eliminar un electrón de valencia de la molécula de analito (Figura\(\PageIndex{2}\)). A medida que el electrón pasa cerca de la molécula, la carga negativa del electrón repele y distorsiona la nube de electrones que rodea a la molécula. Esta distorsión transfiere la energía cinética del electrón que se mueve rápidamente a la nube de electrones de la molécula. Si el proceso transfiere suficiente energía, la molécula expulsará un electrón de valencia y formará un catión radical M •+.
Dado que la ionización es producida por un solo electrón que se acelera a 70 V, esto se conoce comúnmente como 70 eV EI. ** Esta es suficiente energía para causar una fragmentación extensa, y en este nivel pequeños cambios en la energía de los electrones no afectan significativamente los patrones de fragmentación. La cantidad de energía transferida durante este proceso depende hasta de qué tan rápido viaja el electrón y qué tan cerca pasa a la molécula. En la mayoría de los experimentos de 70 eV EI, aproximadamente 1400 kJ (15 eV) de energía se transfieren durante el proceso de ionización. Sin embargo, existe una distribución de energía y hasta 2800 kJ (30 eV) se transfieren a algunas moléculas. Dado que se requieren aproximadamente 960 kJ/mol (10 eV) de energía para ionizar la mayoría de los compuestos orgánicos y una energía de enlace químico típica es de 290 kJ/mol (3 eV), a menudo se observa una fragmentación extensa en los espectros de masas EI de 70 eV. La distribución de la energía transferida durante la ionización y el gran número de vías de fragmentación dan como resultado una variedad de productos para un analito dado. Se pueden usar otros voltajes de electrones para variar la cantidad de fragmentación producida durante la ionización. Para la mayoría de los compuestos orgánicos, la energía umbral para EI es de aproximadamente 20 eV.
Debido a que un espectro de masas se produce ionizando muchas moléculas, el espectro es una distribución de los posibles iones producto. Se observan iones moleculares intactos a partir de iones producidos con poco exceso de energía. Otros iones moleculares se forman con más energía y sufren fragmentación en la región fuente. La abundancia de los fragmentos resultantes, a menudo llamados iones producto, está determinada por la cinética de las vías de fragmentación y la energía de ionización. El cambio de la energía de ionización cambia la distribución observada de iones fragmentos. Esta distribución proporciona la información estructural para interpretar los espectros de masas y se discute en detalle en la sección de interpretación.
* Alguna literatura más antigua se referirá a la IE como impacto electrónico, pero este término no se considera exacto. La ionización de electrones es el término actualmente aceptado.
** La unidad SI para la energía es el Joule. La energía de las reacciones químicas se expresa típicamente en kilojulios por mol. En muchos experimentos en fase gaseosa (como la espectrometría de masas), el mol no es una unidad conveniente. El electrón voltio se utiliza frecuentemente como unidad de energía para moléculas individuales o átomos. 1 eV = 1.60217733 (49) x 10 -19 J. Así que: 1 eV (por molécula o átomo) = 96.4152206 kJ/mol.


