3.2: Ionización química
- Page ID
- 77741
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Ionización química (1, 2)
La ionización química (CI) es una técnica de ionización suave que produce iones con poco exceso de energía. Como resultado, se observa menos fragmentación en el espectro de masas. Dado que esto aumenta la abundancia del ión molecular, la técnica es complementaria a 70 eV EI. El CI se utiliza a menudo para verificar la masa molecular de un desconocido. Solo se requieren ligeras modificaciones de una región fuente de EI para los experimentos de IC.
En Ionización Química la fuente está encerrada en una celda pequeña con aberturas para el haz de electrones, el gas reactivo y la muestra. El gas reactivo se agrega a esta celda a una presión de aproximadamente 10 Pa (0.1 torr). Esto es mayor que la presión de 10 -3 Pa (10 -5 torr) típica para una fuente de espectrómetro de masas. A 1 0 -3 Pa la trayectoria libre media entre colisiones es de aproximadamente 2 metros y las reacciones ión-molécula son poco probables. En la fuente de CI, sin embargo, la trayectoria libre media entre colisiones es de solo 10 -4 metros y las moléculas de analito experimentan muchas colisiones con el gas reactivo. El gas reactivo en la fuente de CI se ioniza con un haz de electrones para producir una nube de iones. Los iones de gas reactivo en esta nube reaccionan y producen iones aductos como\(\mathrm{CH}_{5}^{+}\) (Figura\(\PageIndex{1}\)), que son excelentes donantes de protones.
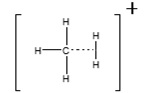
Cuando las moléculas de analito se introducen en una región fuente con esta nube de iones, los iones de gas reactivo donan un protón a la molécula de analito y producen iones aductos, [M+H] +. La energía de la transferencia de protones se controla mediante el uso de diferentes gases reactivos. Los gases reactivos más comunes son el metano, el isobutano y el amoníaco. El metano es el donante de protones más fuerte comúnmente utilizado con una afinidad protónica (PA) de 5.7 eV. Para una ionización más suave, se utilizan frecuentemente isobutano (PA 8.5 eV) y amoníaco (PA 9.0 eV). Química ácido-base útil para describir estas reacciones químicas de ionización. El gas reactivo debe ser un ácido de Brønsted lo suficientemente fuerte como para transferir un protón al analito. La fragmentación se minimiza en el CI al reducir la cantidad de exceso de energía producida por la reacción. Debido a que los iones aductos tienen poco exceso de energía y son relativamente estables, el CI es muy útil para la determinación de la masa molecular. Algunas reacciones típicas en una fuente de CI se muestran en la Figura\(\PageIndex{2}\).
\[\begin{gathered} \mathrm{CH}_{4}+\mathrm{e}^{-} → \mathrm{CH}_{4}^{+} + 2 \mathrm{e}^{-} \end{gathered} \nonumber \]
B) Reacción de iones de gas reactivo para formar aductos:
\[\begin{gathered} \mathrm{CH}_{4}^{+}+\mathrm{CH}_{4} → \mathrm{CH}_{3} + \mathrm{CH}_{5}^{+} \\ \mathrm{OR} \\ \mathrm{CH}_{4}^{+} → \mathrm{CH}_{3}^{+} + \mathrm{H} \\ \mathrm{CH}_{3}^{+}+\mathrm{CH}_{4} → \mathrm{C}_{2} \mathrm{H}_{5}^{+}+\mathrm{H}_{2} \end{gathered} \nonumber \]
C) Reacción de iones de gas reactivo con moléculas de analito:
\[\begin{gathered} \mathrm{CH}_{5}^{+}+\mathrm{M} → \mathrm{CH}_{4} + \mathrm{MH}^{+} \\ \mathrm{C}_{2} \mathrm{H}_{5}^{+}+\mathrm{M} → \mathrm{C}_{2} \mathrm{H}_{4}+\mathrm{MH}^{+} \\ \mathrm{CH}_{3}^{+}+\mathrm{M} → \mathrm{CH}_{4} + (\mathrm{M-H})^{+} \end{gathered} \nonumber \]
Referencias
- Munson, B. Anal. Chem. 1977, 49, 772A-778A.
- Munson, B.; Field, F. J. Am. Chem. Soc., 1966, 88, 2621-2630.


