8.1: Ion Molecular
- Page ID
- 77744
Ion Molecular
El ion molecular proporciona la masa molecular del analito y es la primera pista utilizada para interpretar un espectro de masas. La relación masa/carga del ion molecular se basa en la masa del isótopo más abundante para cada elemento de la molécula. Esta no es la masa atómica relativa de la tabla periódica. Dado que muchos espectrómetros de masas tienen resolución de masa unitaria, la masa isotópica normalmente se redondea al número entero más cercano, esto se denomina masa nominal. Por ejemplo el ion molecular para ChBr 3 se observa a 250 m/z ;( 12 + 1 + 3\(\times\) 79)=250), no al peso molecular relativo de 253. La masa del ion molecular se basa en la masa del isótopo con mayor abundancia natural. El isótopo de bromo más común es 79 Br. No utilice el peso atómico promedio ponderado para Br (79.9) que se basa en la abundancia natural de 79 Br y 81 Br. El espectro de masas de ChBr 3 incluye iones para todos los isótopos naturales y la intensidad de cada pico depende de la probabilidad de esa combinación de isótopos. Estos patrones se discuten en detalle en la sección sobre abundancia de isótopos.
En muchos espectros de masas, el ion molecular se identifica fácilmente como el ion con la relación masa/carga más alta. Sin embargo, esta asignación debe hacerse con precaución porque la mayor masa para cargar el ion puede ser una impureza, un isótopo del ión molecular o un fragmento. Muchos compuestos se fragmentan fácilmente y no se observan iones moleculares en el espectro de 70 eV EI. Es importante aclarar que el ion molecular NO ES necesariamente el ion con mayor abundancia, el ion con mayor abundancia se llama el pico base. El pico base es el pico con mayor abundancia. El espectro de masas suele normalizarse para que este pico tenga una intensidad de 100.
Una lista de características de iones moleculares se encuentran en la Tabla\(\PageIndex{1}\) para ayudarle a identificarlas en un espectro de masas. EI de baja energía, donde se reduce la energía de ionización, a menudo aumenta en intensidad del ion molecular. La ionización química, CI, también es útil para identificar el ion molecular, ya que el ion aducto suele ser más estable que el catión radical producido por la ionización electrónica. El ion aducto a menudo se forma protonando el analito para formar y\((\mathrm{M}+\mathrm{H})\) and se observa a una relación masa/carga de M+1.
| La relación masa/carga debe corresponder a una fórmula molecular razonable con la abundancia de isótopos adecuada. |
| La mayoría de los compuestos tienen una masa molecular uniforme. La única excepción común a esto es la “Regla del Nitrógeno” que se discute a continuación. |
| La Regla del Nitrógeno: Cualquier compuesto con un número impar de átomos de nitrógeno tendrá una masa molecular impar. Cualquier compuesto con un número par de átomos de nitrógeno (incluyendo cero) tendrá una masa molecular par. Esto se debe a que el nitrógeno es el único átomo común donde el isótopo más común tiene una valencia impar y una masa par. Por ejemplo: el ion molecular para CH 4 se observa a 16 m/z, el ion molecular para NH 3 se observa a 17 m/z, y el ion molecular para N 2 H 4 se observa a 32 m/z. |
| Si un pico es el ion molecular, el siguiente fragmento de mayor masa debe corresponder a la pérdida de un posible fragmento neutro. Por ejemplo, un pico que corresponde a una pérdida de 5 u del ion molecular es altamente improbable |
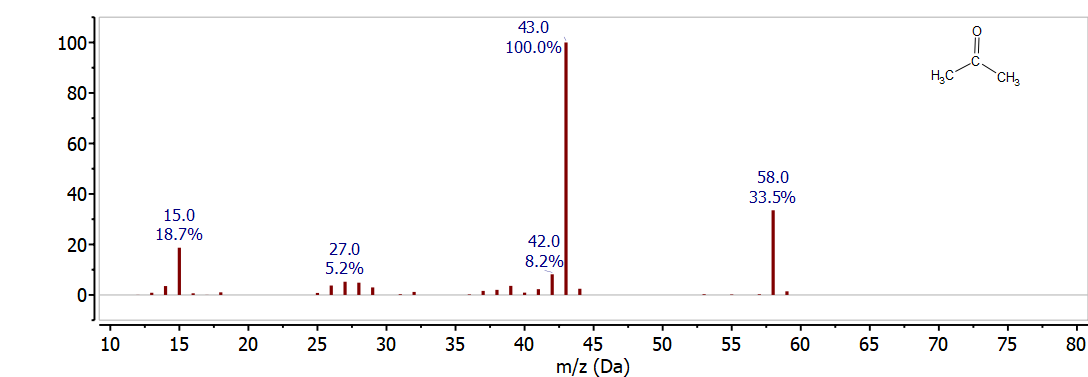
La figura\(\PageIndex{1}\) muestra el espectro de masas de acetona (CH 3 COCH 3). El ion molecular se muestra claramente a 58 m/z (12 x 3 + 6 x 1 + 16 = 58). El pico base se encuentra a 43 m/z y corresponde a una pérdida de 15 m/z de la molécula intacta, esto es causado por la ruptura de un enlace C-C por pérdida de un radical CH 3 • para dar CH 3 CO + a 43 m/z (12 x 2 + 3 x 1 + 16 = 43). El espectro de masas también incluye varios otros picos menores - el pico a 59 m/z es causado por la pequeña abundancia de C-13 que da a una pequeña fracción de las moléculas de acetona una masa de 59; el pico a 15 m/z es causado por el fragmento CH 3 que retiene el carga cuando se rompe el enlace C-C. Estos patrones de fragmentación e isótopos se discuten con más detalle en las siguientes secciones.