8.2: Fragmentación
- Page ID
- 77751
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Fragmentación
Aunque el ion molecular es útil para la identificación, no proporciona ninguna información estructural sobre un desconocido. La información estructural se obtiene de los patrones de fragmentación del espectro de masas. Identificar un desconocido sin analizar los patrones de fragmentación es como armar un rompecabezas sin la imagen. Los patrones de fragmentación suelen ser complejos, pero encajan como piezas del rompecabezas para identificar la estructura de la molécula.
Después de que una molécula se ioniza, el ion molecular retiene el exceso de energía de ionización. Si este exceso de energía es mayor que la energía requerida para romper un enlace químico, la molécula puede fragmentarse. Los procesos de fragmentación se categorizan típicamente como escisión directa donde se rompe un enlace sencillo o reordenamiento donde los enlaces se rompen y se crean simultáneamente (Figura\(\PageIndex{1}\)).
- Ionización Electrónica: ABCD + e - → ABCD +• + 2e -
- Fragmentación:
- Escote Directo ABCD +• → AB + + CD •
- Reordenamiento ABCD +• → AD +• + B=C
El ion molecular formado por ionización electrónica es un ion de electrones impares, una especie radical con un electrón desapareado. Estos iones se forman eliminando un electrón de par solitario o un electrón de enlace de una molécula durante la ionización. Por ejemplo, el agua se ioniza eliminando un electrón no enlazante del oxígeno para producir\(\mathrm{H}_{2} \mathrm{O}^{+1}\). Este es un ejemplo de un ion electrón impar. Los iones de electrones impares tienen un valor de masa par para cargar. La excepción a esto es si el ion tiene un número impar de átomos de nitrógeno. Calcular el valor de masa a cargar para algunos iones moleculares para verificar esta afirmación.
Cuando un ion molecular fragmenta por escisión directa un enlace sencillo se rompe para producir dos fragmentos. Esto suele separar la carga y el radical del ion molecular. La escisión directa produce un ion de electrones par, AB +, y un radical neutro de electrones impares, CD •. El ion electrón par se detecta a un valor impar de masa a carga (suponiendo que no hay nitrógeno) y como el radical es un fragmento neutro no se observa en el espectro de masas. Incluso los iones de electrones tienen todos los electrones emparejados. Un ejemplo de esto se mostró en el espectro de masas de acetona donde el ion molecular, CH 3 —CO—CH 3 +•, se fragmentó para formar CO—CH 3 + - un ion de electrones par observado a 43 m/z. El radical CH 3 • tiene una masa impar pero como es neutro este fragmento no se observa en el espectro de masas. Es posible que la carga y las especies radicales cambien. Como resultado, la escisión de CH 3 —CO—CH 3 +• también puede formar CH 3 + que es un ion de electrones par observado a 15 m/z, una masa impar. No se observaría el radical formado por esta escisión, CO—CH 3 •. En el espectro de masas de acetona el pico de 43 m/z es mucho mayor que el pico de 15 m/z, por lo que se favorece claramente la formación de CO—CH 3 + a 43 m/z. Cuando estés interpretando espectros de masas busca posibles fragmentos de escisión pero ten en cuenta que uno o ambos fragmentos pueden ser observados en el espectro de masas.
Los reordenamientos son reacciones más complejas que implican tanto hacer como romper vínculos. Estas reacciones son termodinámicamente favorables porque requieren menos energía. Sin embargo, también requieren un mecanismo concertado que no sea tan cinéticamente favorable en comparación con una simple reacción de escisión. Los iones de reordenamiento se identifican fácilmente porque se observan como iones de electrones impares con un valor par de m/z. Estos fragmentos a menudo proporcionan pistas importantes sobre la ubicación e identidad de ciertos grupos funcionales. Los reordenamientos se discuten con más detalle en la siguiente sección.
Los espectros de masas de 4\(\mathrm{C}_{4} \mathrm{H}_{10} \mathrm{O}\) isómeros diferentes se muestran en las Figuras 16 a 19. Estos espectros muestran cómo los patrones de escisión ayudan a identificar la estructura de un compuesto. Es importante recordar que determinar la fórmula molecular es solo el primer paso en la interpretación de los espectros de masas.
1-Butanol
En este punto consigue un trozo de papel rascar, dibujar una estructura de punto Lewis para 1-butanol, encontrar la masa del ion molecular, romper algunos enlaces y encontrar la masa de algunos fragmentos posibles. Después, mire para ver cuáles de estos fragmentos se observan en el espectro de masas. Este ejercicio llevará algún tiempo, pero la práctica te ayudará a aprender a interpretar los espectros de masas. Después de tener algunas posibilidades, eche un vistazo a Figura\(\PageIndex{2}\) y vea lo que puede encontrar.

Para el 1-butanol el ion molecular debe observarse a 74 m/z (4x12 + 10x1 + 1x16 = 74). Hay un pico muy pequeño en esta ubicación, que no es inusual alcoholes - y muchas otras clases compuestas. Si miras los espectros de masas para una gran cantidad de alcoholes notarás que a menudo muestran poca o ninguna intensidad de iones moleculares. Esto hace que la interpretación de sus espectros sea desafiante y los espectros IR -que muestran muy claramente grupos funcionales OH- complementen los espectros de masas al ayudar a identificar estos grupos funcionales. Si sabes por el IR que un compuesto es un alcohol puedes tener cuidado al identificar el ion molecular, sabiendo que puede que no se observe.
Siguiente mirada a los posibles fragmentos de escisión del ión molecular. Una posibilidad es la pérdida de hidrógeno para dar 73 m/z. Hay un pequeño pico a 73 m/z en el espectro de masas -eso indica que esta fragmentación es posible pero no es común. Lo mismo es cierto también para la pérdida de OH • - que se observa con un pequeño pico a 57 m/z (74 - 17). La siguiente pérdida es alfa-clevage, rompiendo el enlace C-C junto al grupo funcional OH, para formar CH 2 OH +, observado a 31 m/z (CH 2 OH +) o el complemento, CH 3 CH 2 CH 2 +, observado a los 43 m/z. Dado que la carga podría ser retenida por cualquiera de los fragmentos, ambos se observan en el espectro. La escisión alfa es un patrón de fragmentación común para los alcoholes, por lo que observar un pico a 31 m/z es útil para identificar alcoholes primarios.
El espectro de 1-butanol también tiene un pico principal a 56 m/z. Este es un ion de masa uniforme por lo que no se forma rompiendo un enlace sencillo. Mirar la pérdida del ion molecular a este fragmento (74 - 56 = 18) es una pista de la identidad. Los alcoholes suelen sufrir pérdida de agua (H 2 O - 18 m/z, por lo que 56 m/z es un pico probable para 1-butanol. Este reordenamiento es favorable porque el agua es muy estable y el ion radical resultante, CH 2 =CH-CH 2 -CH 3 +, tiene la misma estructura que un alqueno. Los reordenamientos son mucho más probables cuando crean una especie estable. El otro pico significativo en este espectro de masas se encuentra a 41 m/z. No es posible obtener esta masa rompiendo un enlace sencillo por lo que también debe implicar algún tipo de reordenamiento. No es inusual que se produzca la fragmentación y pérdida de H 2, por lo que este ion podría formarse por escisión alfa seguida de pérdida de H 2. Dado que H 2 es una molécula intacta, esta fragmentación es energéticamente favorable aunque también requiere algún reordenamiento.
2-Butanol
El siguiente espectro a examinar es el 2-butanol. Antes de observar el espectro de masas, dibuje la estructura de puntos de Lewis para 2-butanol y determine la masa de los posibles fragmentos de escisión alfa. Luego compara tus resultados con el espectro de la Figura\(\PageIndex{3}\).
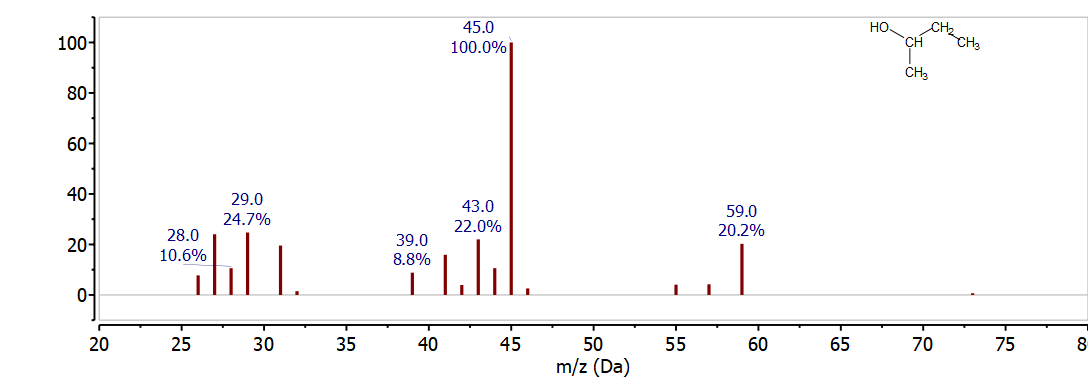
Dado que el 2-butanol tiene la misma fórmula molecular que el 1-butanol, C 4 H 10 O, también tiene el mismo ion molecular a 74 m/z. El ion molecular no se ve en la Figura 17 pero hay varios iones fragmentos muy informativos observados en el espectro de masas. A partir del análisis del 1-butanol, es razonable buscar fragmentos de escisión alfa. Dado que se trata de un alcohol secundario, existen dos posibles localizaciones de escisión alfa para el 2-butanol. La escisión alfa podría resultar en la pérdida de CH 3 • o C 2 H 5 • para producir iones observados a 59 m/z (74 - 15) y 45 m/z (74 - 29) respectivamente. Ambos picos se observan en la Figura 17 y su alta intensidad distingue claramente este espectro de masas del 1-butanol. Los iones complemento, CH 3 + o C 2 H 5 + se observan a 15 m/z y 29 m/z pero no son particularmente útiles para la identificación ya que están presentes en casi todos los espectros de masas orgánicos.
2-Metil-1-propanol
El siguiente espectro a examinar es el 2-metil-1-propanol. Antes de observar el espectro de masas en la Figura\(\PageIndex{4}\), dibuje la estructura de puntos de Lewis para 2-metil-1-propanol y determine la masa de los posibles fragmentos de escisión alfa. Entonces compara lo que encuentres con el espectro a continuación.

Dado que el 2-metil-1-propanol tiene la misma fórmula molecular que el 1-butanol y el 2-butanol, C 4 H 10 O, también tiene el mismo ion molecular a 74 m/z. Aunque el ion molecular a 74 m/z no se observó fácilmente en los dos espectros anteriores, se observa claramente para 2-metil-1-propanol en la Figura 18. Con base en la discusión de los dos espectros anteriores, también debemos buscar fragmentos de escisión alfa. Con base en la estructura para la escisión alfa del 2-metil-1-propanol resultaría en una pérdida de C 3 H 7 • para formar CH2OH + que se observa a 31 m/z y es característica de un alcohol primario. El ion complemento C 3 H 7 + a 43 m/z también se observa en la Figura 18. Dado que el C 3 H 7 + a 43 m/z es un carbocatión secundario es más estable que el ion C 3 H 7 + formado a partir de la fragmentación del 1-butanol. Como resultado, el pico a 43 m/z es el pico base en el espectro de 2-metil-1-propanol. La intensidad relativa de picos como este es muy importante para distinguir los espectros de masas de compuestos similares. También se puede comparar la intensidad relativa de los picos a 31 m/z y 43 m/z en los espectros de 1-butanol y 2-metil-1-propanol.
2-metil-2-propanol
El siguiente espectro a examinar es el 2-metil-2-propanol. Antes de observar el espectro de masas, dibuje la estructura de puntos de Lewis para 2-metil-2-propanol y determine la masa de los posibles fragmentos de escisión alfa. Después compara lo que encuentres con el espectro en Figura\(\PageIndex{5}\).

El ion molecular no se observa para 2-metil-1-propanol en la Figura 19. Sin embargo, el pico de escisión alfa que muestra pérdida de CH 3 • a 59 m/z es el pico base y es mucho más abundante que cualquier otro ion en el espectro. Hay dos razones para ello, la primera es que existen tres localizaciones diferentes en la estructura donde la escisión alfa da como resultado la pérdida de CH 3 •. Esto por sí solo aumentaría la probabilidad de formar 59 m/z pero la consideración adicional es que el carbocatión C 3 H 7 O + producido por la escisión alfa es un carbocatión terciario. Como resultado es mucho más estable y por lo tanto menos probable que sufra una mayor fragmentación.
C 4 H 10 O Resumen
Es evidente a partir de los espectros mostrados en las Figuras 16-19 que los espectros de masas para estas cuatro estructuras diferentes C 4H 10 O se distinguen fácilmente en base a los patrones de escisión alfa. Aprender patrones de fragmentación comunes para diferentes grupos funcionales es muy útil para identificar incógnitas y para distinguir los espectros para compuestos similares.
Tolueno
El espectro de masas para tolueno se muestra en la Figura\(\PageIndex{6}\). Dada la estabilidad de los compuestos aromáticos no debería sorprender que el ion molecular a 92 m/z tenga una alta intensidad. El pico base observado a 91 m/z es interesante porque la pérdida de H • no suele ser tan intensa. Resulta que el ion tropilio, C 7 H 7 +, también es aromático y por lo que este fragmento es muy estable y a menudo tiene una alta intensidad.



