5.6: Técnicas de Temperatura Programada
- Page ID
- 69079
Existen diversas técnicas para estudiar reacciones superficiales y adsorción molecular en superficies que utilizan la programación de temperatura para discriminar entre procesos con diferentes parámetros de activación. De estos, el más útil para estudios monocristalinos es: Desorción Programada por Temperatura (TPD). Cuando la técnica se aplica a un sistema en el que el proceso de adsorción es, al menos en parte, irreversible y la programación T conduce a reacciones superficiales, entonces esta técnica suele ser conocida como: Espectroscopia de Reacción Programada por Temperatura (TPRS)
Sin embargo, no hay diferencia sustantiva entre TPRS y TPD. El experimento básico es muy sencillo, involucrando
- Adsorción de una o más especies moleculares sobre la superficie de la muestra a baja temperatura (frecuentemente 300 K, pero a veces subambiente).
- Calentamiento de la muestra de manera controlada (preferiblemente para dar una rampa lineal de temperatura) mientras se monitorea la evolución de especies desde la superficie de regreso a la fase gaseosa.
En las implementaciones modernas de la técnica el detector de elección es un pequeño espectrómetro de masas cuadrupolo (SGC) y todo el proceso se lleva a cabo bajo control informático con monitoreo cuasi-simultáneo de una gran cantidad de productos posibles.
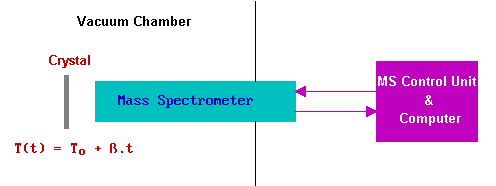
Los datos obtenidos de dicho experimento consisten en la variación de intensidad de cada fragmento de masa registrado en función del tiempo/temperatura. En el caso de un simple proceso de adsorción reversible sólo puede ser necesario registrar una señal -la atribuible al ion molecular del adsorbato en cuestión.
La gráfica a continuación muestra los datos de un experimento de TPD después de la adsorción de CO sobre un cristal de Pd (111) a 300 K.
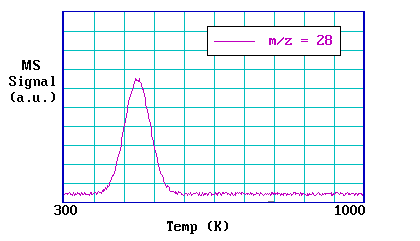
Dado que se utiliza la detección espectrométrica de masas, la sensibilidad de la técnica es buena con límites de detección alcanzables por debajo de 0.1% de una monocapa de adsorbato.
Cabe destacar los siguientes puntos:
- El área bajo un pico es proporcional a la cantidad originalmente adsorbida, es decir, proporcional a la cobertura superficial.
- La cinética de desorción (obtenida del perfil de pico y la dependencia de cobertura de las características de desorción) dan información sobre el estado de agregación de las especies adsorbidas, por ejemplo, las v moleculares disociativas.
- La posición del pico (la temperatura máxima) está relacionada con la entalpía de adsorción, es decir, con la fuerza de unión a la superficie.
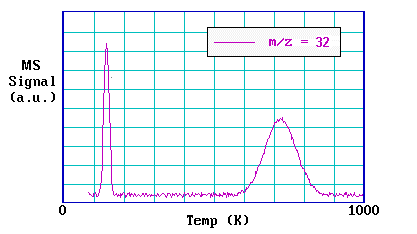
Una implicación del último punto, es que si hay más de un estado de unión para una molécula en una superficie (y éstas tienen entalpías de adsorción significativamente diferentes) entonces esto dará lugar a múltiples picos en el espectro de TPD.
La gráfica siguiente muestra datos de un experimento de TPD después de la adsorción de oxígeno en Pt (111) a 80 K.
Teoría de la TPD
Como se discute en la Sección 2.6, la tasa de desorción de una especie de superficie vendrá dada en general por una expresión de la forma:
\[R_{des} = ν N^x \exp \left( \dfrac{- E_a^{des} }{ R T} \right) \label{1}\]
con
- \(R_{des}\)- tasa de desorción (\(= -dN/dt\))
- \(x\)- orden cinético de desorción (típicamente 0,1 o 2)
- \(E_a^{des}\)- energía de activación para desorción
En un experimento de desorción programada de temperatura en el que la temperatura se incrementa linealmente con el tiempo a partir de alguna temperatura inicial\(T_o\), entonces:
\[T = T_o + βt \label{2a}\]
y
\[dT = β\,dt \label{2b}\]
La intensidad de la señal de desorción, I (T), es proporcional a la velocidad a la que disminuye la concentración superficial de las especies adsorbidas. Esto se obtiene combinando [1] y [2] para dar
\[ I(T) \propto \dfrac{dN}{dT} = \dfrac{\nu N^x}{\beta} e^{-E_a^{des}/RT} \label{3}\]
Este problema también puede considerarse de una manera gráfica bastante simplista -la clave de esto es reconocer que la expresión para la señal de desorción dada en la ecuación anterior es básicamente un producto de un término de cobertura (\(N^x\)- donde\(N\) depende de\(T\)) y un término exponencial ( involucrando a ambos\(E_a\) y\(T\)).
Inicialmente, a bajas temperaturas\(E_a >> RT\) y el término exponencial está desapareciendo poco. Sin embargo, a medida que aumenta la temperatura este término comienza a aumentar muy rápidamente cuando el valor de RT se acerca al de la energía de activación,\(E_a\).
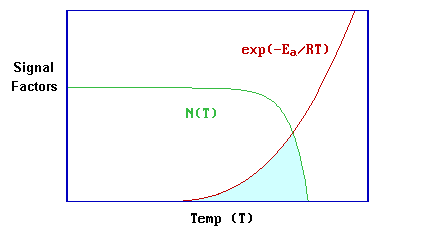
Por el contrario, el término preexponencial depende de la cobertura, N (T), a la temperatura de que se trate; este término permanecerá en el valor inicial hasta que la tasa de desorción llegue a ser significativa como resultado del creciente término exponencial. A partir de entonces, disminuirá cada vez más rápidamente hasta que la cobertura se reduzca a cero. El área sombreada es una representación aproximada del producto de estas dos funciones y, por lo tanto, también una representación aproximada de la señal de desorción misma; si bien esta ilustración puede ser demasiado simplista, muestra claramente por qué el proceso de desorción da lugar a un pico de desorción bien definido.
Si desea ver exactamente cómo los diversos factores como el orden cinético y la cobertura inicial influyen en el perfil de desorción entonces pruebe la Demostración Interactiva de Desorción Programada por Temperatura (nota - esto se basa en las fórmulas dadas en la Sección 2.6); nosotros lo haremos sin embargo, seguir viendo un caso en particular con un poco más de detalle.
CASO I (Adsorción molecular)
En este caso, la cinética de desorción suele ser de primer orden (es decir\(x = 1\)). La señal de desorción máxima en la\(I(T)\) traza ocurrirá cuando (\(dI / dT\)) = 0, es decir, cuando
\[ \dfrac{d}{dT}\left[ \dfrac{\nu N}{\beta} \; \exp \left( \dfrac{-E_a^{des}}{RT} \right) \right] = 0 \]
Por lo tanto, recordando que la cobertura superficial cambia con la temperatura, es decir\(N = N(T)\),

donde hemos sustituido\(E_a\) por\(E_a^{des}\) puramente por claridad de presentación. Sustituyendo\(dN/dT\) de la ecuación 3 luego da

La solución se da estableciendo la expresión entre corchetes para que sea igual a cero, es decir,
\[ \dfrac{E_a}{RT^2_p}=\dfrac{\nu}{\beta}\; \exp \left(\dfrac{-E_a}{RT_p} \right)\]
donde ahora hemos definido que la temperatura a la que se produce el máximo de desorción es T = T p (la temperatura pico).
Desafortunadamente, esta ecuación no se puede reorganizar para hacer\(T_p\) el sujeto (es decir, para dar una expresión simple de la forma T p =...), pero podemos señalar que:
- como\(E_a^{des}\) (la energía de activación para la desorción) aumenta, entonces así\(T_p\) (la temperatura máxima) aumenta.
- la temperatura pico no depende de, y en consecuencia no cambia con, la cobertura inicial,\(N_t=0\).
- la forma del pico de desorción tenderá a ser asimétrica, con la señal disminuyendo rápidamente después del máximo de desorción.
Espectroscopía de reacción programada por temperatura
En TPRS, normalmente se detectarán varios productos de desorción en cualquier experimento; aquí es donde la detección espectrométrica de masas y el monitoreo de múltiples iones realmente se vuelven esenciales. Un buen ejemplo de resultados de TPRS son los obtenidos de la dosificación de ácido fórmico (HCOOH) sobre una superficie de cobre.
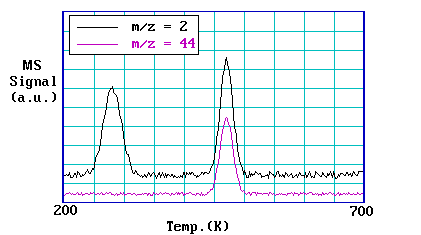
Los espectros contienen dos regiones de interés - la primera alrededor de la temperatura ambiente donde hay desorción de hidrógeno\(H_2\) con\(m/z = 2\) solo, y la segunda entre 400 K y 500 K, donde hay picos de desorción coincidentes atribuibles al hidrógeno y dióxido de carbono\(CO_2\) con\(m/z = 44\).
El pico de hidrógeno de menor temperatura se encuentra aproximadamente a la misma temperatura a la que los átomos de hidrógeno se recombinan y desorben como hidrógeno molecular de una superficie de Cu (110) dosificada con hidrógeno, es decir, la cinética de su evolución a la fase gaseosa son las del proceso normal de desorción recombinativa. Por el contrario, el pico de hidrógeno de mayor temperatura se observa muy por encima de la temperatura normal de desorción de hidrógeno; su apariencia debe regirse por la cinética de descomposición de otra especie superficial. El pico de dióxido de carbono también debe estar limitado por descomposición ya que en Cu (110) limpio el dióxido de carbono en sí solo se fisisorbe débilmente a temperaturas muy bajas.
De manera más general, la desorción coincidente de dos especies a temperaturas muy superiores a sus temperaturas normales de desorción es característica de la descomposición de una especie superficial más compleja.


