5.1: Topología de Interacción Orbital
- Page ID
- 74659
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \) \( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)\(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\) \(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\)\(\newcommand{\AA}{\unicode[.8,0]{x212B}}\)
Las interacciones orbitales determinan cuántos y qué orbitales moleculares tendrán energías bajas (enlazantes), intermedias (no enlazantes) y superiores (antiligantes), con todas las energías vistas en relación con las de los orbitales atómicos constituyentes. Los patrones generales que se observan en la mayoría de los compuestos se pueden resumir de la siguiente manera:
- Si las divisiones de energía entre los orbitales atómicos de un átomo dado con el mismo número cuántico principal son pequeñas, la hibridación puede ocurrir fácilmente para producir orbitales híbridos que se dirigen hacia (y quizás lejos de) los otros átomos en la molécula. En los elementos de la primera fila (Li, Be, B, C, N, O y F), la división 2s-2p es pequeña, por lo que la hibridación es común. En contraste, para Ca, Ga, Ge, As y Br es menos común, debido a que la división 4s-4p es mayor. Los orbitales dirigidos hacia otros átomos pueden formar mos de enlace y antiunión; los dirigidos hacia ningún otro átomo formarán orbitales moleculares no enlazantes.
- Al intentar obtener una imagen cualitativa de la estructura electrónica de cualquier molécula dada, es ventajoso comenzar por hibridar los orbitales atómicos de aquellos átomos que contienen más de un ao en su caparazón de valencia. Solo aquellos orbitales atómicos que no están involucrados en las interacciones p-orbitales deben ser así hibridados.
- Los orbitales atómicos o híbridos que no se dirigen de una manera de interacción s hacia otros orbitales atómicos o híbridos en átomos vecinos pueden estar involucrados en interacciones p o en interacciones no enlazantes.
- Pares de orbitales atómicos u orbitales híbridos en átomos vecinos dirigidos uno hacia el otro interactúan para producir orbitales enlazantes y antiligantes. Cuanto más se encuentre el orbital de unión por debajo del ao de menor energía o orbital híbrido involucrado en su formación, mayor será el orbital antiadhesión por encima del ao de mayor energía o orbital híbrido.
Por ejemplo, en formaldehído\(H_2CO\), uno forma\(sp^2\) híbridos en el átomo de C; en el átomo de O, cualquiera de los híbridos sp (con un orbital p “reservado” para su uso en la formación de los\(\pi \text{ and } \pi^{\text{*}}\) orbitales y otro orbital p para ser utilizado como orbital no enlazante que se encuentra en el plano del molécula) o\(sp^2\) híbridos (con el orbital p restante reservado para los\(\pi \text{ and } \pi^{\text{*}}\) orbitales). Los átomos de H utilizan sus orbitales 1s ya que la hibridación no es factible para ellos. El átomo de C usa claramente sus\(sp^2\) híbridos para formar dos pares orbitales CH y uno CO\(\sigma\) enlazante - antienlace.
El átomo de O utiliza uno de sus sp o\(sp^2\) híbridos para formar el\(\sigma\) enlace CO y el antienlace. Cuando se utilizan híbridos sp para conceptualizar la unión, el otro híbrido sp forma un orbital de par solitario dirigido lejos del eje del enlace CO; uno de los orbitales p atómicos está involucrado en los\(\pi \text{ and } \pi^{\text{*}}\) orbitales CO, mientras que el otro forma un orbital no enlazante en el plano. Alternativamente, cuando se utilizan\(sp^2\) híbridos, los dos\(sp^2\) híbridos que no interactúan con la\(sp^2\) órbita del átomo de C forman los dos orbitales no enlazantes. De ahí que la imagen final de orbitales ligantes, no ligantes y antiligantes no depende de qué híbridos se utilicen como intermedios.
Como otro ejemplo, los orbitales 2s y 2p en los dos átomos de N de\(N_2\) pueden formarse en pares de híbridos sp en cada átomo de N más un par de orbitales\(p_{\pi}\) atómicos en cada átomo de N. Los híbridos sp dirigidos hacia el otro átomo de N dan lugar a\(\sigma \text{ and antibonding } \sigma^{\text{*}}\) orbitales de unión, y los híbridos sp dirigidos lejos del otro átomo de N producen\(\sigma\) orbitales no enlazantes. \(_\pi\)Los orbitales p, que consisten en orbitales 2p en los átomos de N dirigidos perpendicularmente al eje del enlace N-N, producen\(\pi \text{ and antibonding } \pi^{\text{*}}\) orbitales de unión. - En general,\(\sigma\) las interacciones para un par dado de átomos que interactúan son más fuertes que\(\pi\) las interacciones (que, a su vez, son más fuertes que\(\delta\) las interacciones, etc.) para cualquier conjunto dado (es decir, el número cuántico principal) de orbitales atómicos que interactúan. De ahí que los orbitales de\(\sigma\) unión (originados de un conjunto dado de aos) se encuentran por debajo de los orbitales de\(\pi\) unión, y\(\sigma^{\text{*}}\) los orbitales se encuentran por encima de\(\pi^{\text{*}}\) orbitales que surgen de los mismos conjuntos de aos. En el\(N_2\) ejemplo, el orbital de\(\sigma\) unión formado a partir de los dos híbridos sp se encuentra por debajo del orbital de\(\pi\) unión, pero el\(\pi^{\text{*}}\) orbital se encuentra por debajo del\(\sigma^{\text{*}}\) orbital. En el\(H_2CO\) ejemplo, los dos orbitales de unión CH y uno CO tienen baja energía; el orbital de\(\pi\) unión de CO tiene la siguiente energía más baja; los dos orbitales no enlazantes de átomos de O tienen energía intermedia; el\(\pi^{\text{*}}\) orbital de CO tiene una energía algo mayor; y los dos CH y uno de CO antiunión los orbitales tienen las energías más altas.
- Si un ao determinado o orbital híbrido interactúa con o se acopla a orbitales en más de un solo átomo vecino, puede ocurrir un enlace multicéntrico. Por ejemplo, en el radical alilo el\(p_\pi\) orbital del átomo de carbono central está acoplado a los\(p_\pi\) orbitales en ambos átomos vecinos; en lineal\(Li_3\), el orbital 2s del átomo central de Li interactúa con los orbitales 2s en ambos átomos terminales de Li; en triangular\(Cu_3\), los orbitales 2s en cada Cu par de átomos a cada uno de los orbitales 4s de los otros dos átomos.
- El enlace multicéntrico que involucra cadenas “lineales” que contienen átomos de N (por ejemplo, como en polienos conjugados o en cadenas de átomos de Cu o Na para los cuales los orbitales de valencia en un átomo interactúan con los de sus vecinos en ambos lados) da lugar a patrones de energía mo en los que hay N/2 (si N es par) o\(N/2 -1\) orbitales de unión no degenerados y el mismo número de orbitales antiadhesión (si N es impar, también hay un orbital único no enlazante).
- El enlace multicéntrico que involucra cadenas “cíclicas” de átomos de N (por ejemplo, como en polienos conjugados cíclicos o en anillos de átomos de Cu o Na para los cuales los orbitales de valencia en un átomo interactúan con los de sus vecinos en ambos lados y toda la red forma un ciclo cerrado) da lugar a patrones de energía mo en los que hay es un orbital no degenerado más bajo y luego una progresión de orbitales doblemente degenerados. Si N es impar, esta progresión incluye (N- 1) /2 niveles; si N es par, hay (N-2) /2 niveles doblemente degenerados y un orbital final no degenerado más alto. Estos patrones y los que aparecen en la unión multicéntrica lineal se resumen en las figuras que se muestran a continuación.
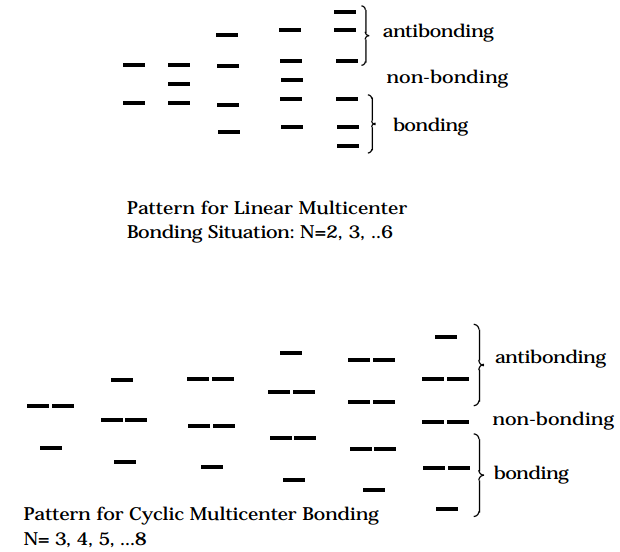
Figura 5.1.1: ¡Inserta el subtítulo aquí!
- En sistemas extendidos como los sólidos, los orbitales basados en átomos se combinan como se indicó anteriormente para formar las llamadas “bandas” de orbitales moleculares. Estas bandas son continuas en lugar de discretas como en los casos anteriores que involucran pequeños polienos. La 'dispersión' de energía dentro de una banda depende de la superposición entre los orbitales basados en átomos que forman la banda; gran superposición da lugar a un ancho de banda grande, mientras que el pequeño solapamiento produce una banda estrecha. A medida que uno se mueve desde la parte inferior (es decir, la parte de energía inferior) de una banda hacia la parte superior, aumenta el número de nodos en la banda orbital correspondiente, como resultado de lo cual disminuye su naturaleza de unión. En la figura que se muestra a continuación, se ilustran las bandas de un metal como Ni (con orbitales 3d, 4s y 4p). La banda orbital d es estrecha porque los orbitales 3d son pequeños y por lo tanto no se superponen apreciablemente; las bandas 4s y 4p son más anchas porque los orbitales 4s y 4p más grandes se superponen en mayor medida. La banda d se divide en\(\sigma, \pi, and \delta\) componentes correspondientes a la naturaleza de las interacciones de superposición entre los orbitales d atómicos constituyentes. Asimismo, la banda p se divide en\(\sigma \text{ and } \pi\) componentes. Los anchos de los\(\sigma\) componentes de cada banda son mayores que los de los\(\pi\) componentes porque las interacciones de\(\sigma\) superposición correspondientes son más fuertes. Las intensidades de las bandas a la energía E miden las densidades de los estados en esa E. La intensidad total integrada bajo una banda dada es una medida del número total de orbitales atómicos que forman la banda.
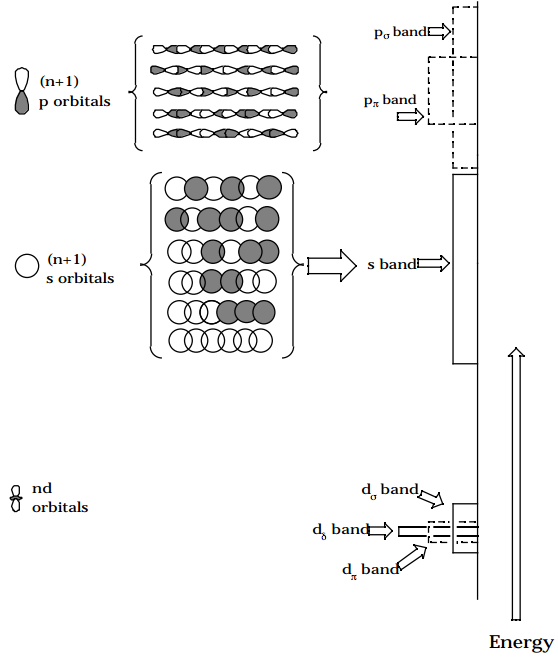
Figura 5.1.2: ¡Inserta el subtítulo aquí!
Colaboradores y Atribuciones
Jack Simons (Henry Eyring Scientist and Professor of Chemistry, U. Utah) Telluride Schools on Theoretical Chemistry and Jeff A. Nichols (Oak Ridge National Laboratory)


