6.2: Diagramas de correlación orbitales - Orígenes de las reglas de Woodward-Hoffmann
- Page ID
- 74630
Conectar los orbitales ordenados por energía de los reactivos a los de los productos de acuerdo con elementos de simetría que se conservan a lo largo de la reacción produce un diagrama de correlación orbital.
En cada uno de los ejemplos citados anteriormente, la reducción de simetría ocurrió a medida que una molécula o átomo se acercaba e interactuaba con otra especie. El “camino” por el que se pensó que se producía este enfoque se caracterizó por la simetría en el sentido de que conservaba ciertos elementos de simetría mientras destruía otros. Por ejemplo, la colisión de dos átomos de Nitrógeno para producir ocurre\(N_2\) claramente de una manera que destruye la simetría esférica pero preserva la simetría axial. En el otro ejemplo usado anteriormente, se postuló que la molécula de formaldehído se descomponía a lo largo de un camino que preserva la\(C_{2v}\) simetría mientras destruye las simetrías axiales del CO y\(H_2.\) La descomposición real del formaldehído puede ocurrir a lo largo de alguna otra trayectoria, pero si ocurriera a lo largo de el camino propuesto, entonces sería útil el análisis de simetría presentado anteriormente.
El análisis de reducción de simetría descrito anteriormente permite ver nuevas interacciones orbitales que surgen (por ejemplo, los 2s y\(2p_z\) las interacciones en el\(N + N \rightarrow N_2\) ejemplo) a medida que aumenta la interacción. También permite construir diagramas de correlación orbital (TOC) en los que los orbitales de los “reactivos” y “productos” están ordenados por energía y etiquetados por las simetrías que se conservan a lo largo del “camino”, y los orbitales son luego correlacionados dibujando líneas que conectan los orbitales de una simetría dada , uno por uno en aumento de energía, desde el lado de los reactivos del diagrama hasta el lado de los productos. Como se señaló anteriormente, dichos diagramas de correlación orbital juegan un papel central en el uso de la simetría para predecir si las reacciones fotoquímicas y químicas térmicas experimentarán barreras de activación a lo largo de las rutas de reacción propuestas (este tema se trata en el Capítulo 12).
Para ilustrar nuevamente la construcción de un TOC, considere los p orbitales del 1,3-butadieno a medida que la molécula experimenta un cierre disrotatorio (observe que aquí es donde se postula un camino particular; la reacción real puede ocurrir o no a lo largo de tal trayectoria) para formar ciclobuteno. A lo largo de este camino, se conserva el plano de simetría que biseca y es perpendicular al\(C_2-C_3\) enlace, por lo que los orbitales del reactivo y del producto se etiquetan como pares e o impares bajo reflexión a través de este plano. No es apropiado etiquetar los orbitales con respecto a su simetría bajo el plano que contiene los cuatro átomos de C; aunque este plano es efectivamente una operación de simetría para los reactivos y productos, no sigue siendo una simetría válida a lo largo de la trayectoria de reacción.
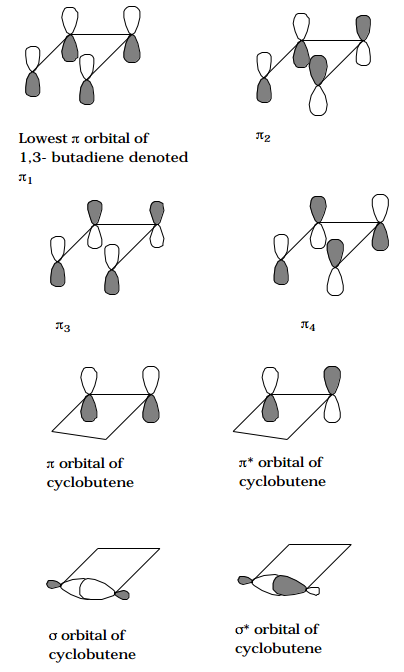
Figura 6.2.1: ¡Inserta el subtítulo aquí!
Los cuatro\(\pi\) orbitales del 1,3-butadieno son de las siguientes simetrías bajo el plano preservado (ver los orbitales en la Figura anterior):\(\pi_1 = e, \pi_2 = 0, \pi_3 = e, \pi_4 = 0.\) Los orbitales\(\pi \text{ and } \pi\) * y\(\sigma \text{ and } \sigma\) * de ciclobutano que evolucionan a partir de los cuatro orbitales activos del 1,3-butadieno son de la siguiente simetría y orden de energía:\(\sigma = e, \pi = e, \pi^\text{*} = 0, \sigma^\text{*} = 0.\) Conectando estos orbitales por simetría, comenzando con el orbital de energía más baja y pasando por el orbital de mayor energía, da el siguiente TOC:
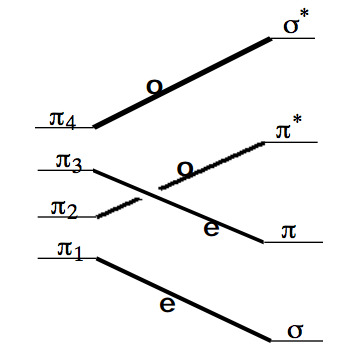
El hecho de que los dos orbitales más bajos de los reactivos, que son los ocupados por los cuatro\(\pi\) electrones del reactivo, no se correlacionen con los dos orbitales más bajos de los productos, que son los orbitales ocupados por los dos\(\sigma \text{ and two } \pi\) electrones de los productos, se mostrará posteriormente en el Capítulo 12 como el origen de la barrera de activación para el reordenamiento disrotatorio térmico (en el que los cuatro electrones activos ocupan estos dos orbitales más bajos) de 1,3-butadieno para producir ciclobuteno.
Si los reactivos pudieran prepararse, por ejemplo por fotólisis, en un estado excitado que tiene ocupación orbital,\(\pi_1^2 \pi_2^1 \pi_3^1,\) entonces la reacción a lo largo de la trayectoria considerada no tendría ninguna barrera impuesta por simetría porque esta configuración excitada individualmente se correlaciona con una configuración\(\sigma^2\pi^1\pi^{\text{*}1}\) de excitación simple del productos. El hecho de que las configuraciones de reactivo y producto sean de nivel de excitación equivalente provoca que no haya restricciones de simetría en la reacción inducida fotoquímicamente de 1,3-butadieno para producir ciclobuteno. En contraste, la reacción térmica considerada primero arriba tiene una barrera impuesta por simetría porque la ocupación orbital se ve obligada a reorganizarse (por la ocupación de dos electrones) de la función de onda en estado fundamental del reactivo para evolucionar suavemente hacia la del producto.
Cabe destacar que aunque estas consideraciones de simetría pueden permitir anticipar barreras en las superficies de energía potencial de reacción, no tienen nada que ver con las diferencias de energía termodinámica de tales reacciones. La simetría dice si habrá barreras impuestas por la simetría por encima y más allá de cualquier diferencia de energía termodinámica. Las entalpías de formación de reactivos y productos contienen la información sobre el balance energético general de la reacción.
Como otro ejemplo de un TOC, considere la reacción de\(N + N \rightarrow N_2\) recombinación mencionada anteriormente. Los orbitales de los átomos deben marcarse primero de acuerdo con el grupo de rotación axial (incluyendo la operación de inversión porque se trata de una molécula homonuclear). Los orbitales del núcleo 1s son simetrías adaptadas para producir\(1\sigma_g \text{ and } 1\sigma_u\) orbitales (el número 1 se usa para indicar que estos son los orbitales de menor energía de sus respectivas simetrías); los orbitales 2s generan\(2\sigma_g \text{ and } 2\sigma_u\) orbitales; los orbitales 2p se combinan para producir\(3\sigma_g\), un par de\(1\pi_u\) orbitales, un par de\(1\pi_g\) orbitales, y el\(3\sigma_u\) orbital, cuya naturaleza de unión, no unión y antiadhesión se detalló anteriormente. En los dos átomos de Nitrógeno separados, los dos orbitales derivados de los orbitales atómicos 2s son degenerados, y los seis orbitales derivados de los orbitales 2p de los átomos de Nitrógeno son degenerados. En la geometría de equilibrio de la\(N_2\) molécula, estas degeneraciones se levantan, Solo quedan las degeneraciones de\(1\pi_u \text{ and } 1\pi_g\) los orbitales, que son dictadas por la degeneración de los orbitales +m y -m dentro del grupo de rotación axial.
A medida que uno avanza hacia adentro más allá de la longitud del enlace de equilibrio de\(N_2\), hacia el límite unitedatom en el que los dos núcleos de Nitrógeno se fusionan para producir un núcleo de Silicio, el orden de energía de los orbitales cambia. Marcando los orbitales del átomo de Silicio según el grupo de rotación axial, uno encuentra el 1s es\(\sigma_g , \text{ the 2s is } \sigma_g ,\text{ the 2p orbitals are } \sigma_u \text{ and } \pi_u\), el orbital 3s es\(\sigma_g\), los orbitales 3p son\(\sigma_u \text{ and } \pi_u ,\text{ and the 3d orbitals are } \sigma_g , \pi_g , \text{ and } \delta_g.\) El siguiente TOC se obtiene cuando uno conecta los orbitales de los dos átomos de Nitrógeno separados (adecuadamente simetría adaptada) a aquellos de la\(N_2\) molécula y eventualmente a los del átomo de Silicio.
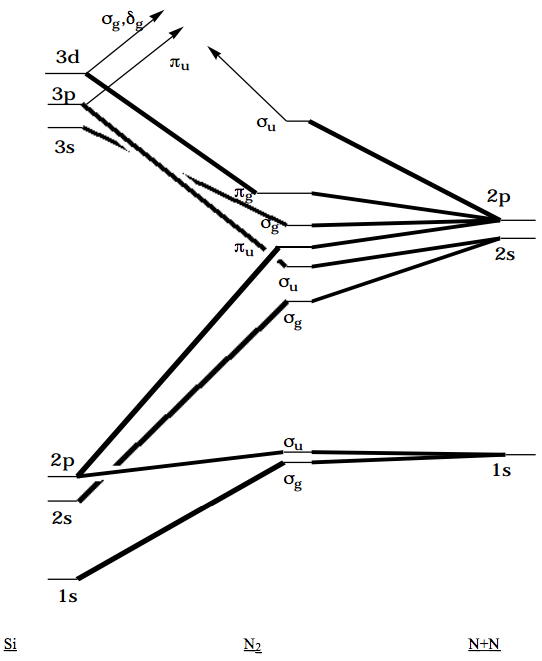
Figura 6.2.3: ¡Inserta el subtítulo aquí!
El hecho de que los límites de átomos separados y átomos unidos impliquen varios cruces en el TOC puede usarse para explicar las barreras en las curvas de energía potencial de tales moléculas diatómicas que ocurren a distancias internucleares cortas. Cabe señalar que los orbitales de\(\pi_u\) simetría 3p del átomo de Silicio y sus orbitales 3d de\(\sigma_g \text{ and } \delta_g\) simetría se correlacionan con orbitales de mayor energía de\(N_2\) no con los orbitales de valencia de esta molécula, y que el orbital antienlace 3su de N2 se correlaciona con un orbital de mayor energía de Silicio (en particular, su orbital 4p).
Colaboradores y Atribuciones
Jack Simons (Henry Eyring Scientist and Professor of Chemistry, U. Utah) Telluride Schools on Theoretical Chemistry and Jeff A. Nichols (Oak Ridge National Laboratory)


