8.2: Uso de ciclos termoquímicos para encontrar cambios en la entalpía
- Page ID
- 74212
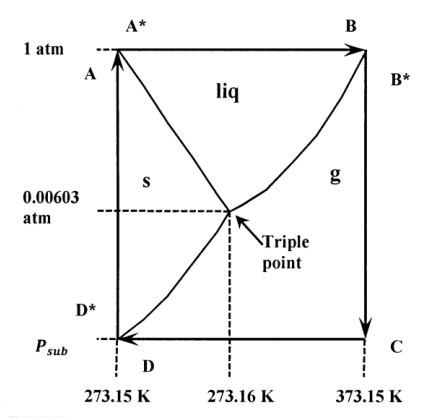
Debido a que la entalpía es una función de estado, el cambio de entalpía al ir entre dos estados cualesquiera de un sistema es independiente del camino. Para una serie de cambios que restaure un sistema a su estado original, la suma de todos los cambios de entalpía debe ser cero. Este hecho nos permite encontrar los cambios de entalpía para muchos procesos para los que es difícil medir el calor y trabajar directamente. Es más fácil ver lo que implica considerando un ejemplo específico. La Figura 1 muestra una trayectoria cíclica, A\(\mathrm{\to }\) A*\(\mathrm{\to }\) B\(\mathrm{\to }\)...\(\mathrm{\to }\) A, superpuesta a una presentación no a escala del diagrama de fases para agua. Veamos la sublimación del hielo en el punto de fusión del agua pura. La sublimación del hielo es la conversión del hielo puro en vapor de agua puro. (El punto de fusión del agua pura es la temperatura a la que el hielo puro está en equilibrio con el agua líquida pura a una presión de una atmósfera; se representa por los puntos A y A* en el diagrama. Queremos encontrar la entalpía de sublimación a la temperatura y presión representadas por los puntos D y D*.)
Los puntos A, A*, D y D* están todos a la misma temperatura; esta temperatura es de aproximadamente 273.153 K o 0.003 C. (Esta temperatura es muy ligeramente superior a 273.15 K o 0 C, que es la temperatura a la que el hielo y el agua están en equilibrio en presencia de aire a una presión total de una atmósfera). Queremos calcular el cambio de entalpía para la conversión de equilibrio de un mol de hielo en agua gaseosa a la presión donde la línea de equilibrio sólido-gas intersecta la línea\(T=\mathrm{273.153\ K}\approx \mathrm{0\ C}\).
En el diagrama, esta presión de sublimación se representa como\(P_{sub}\) y el proceso de sublimación se representa como la transición de D* a D.\(P_{sub}\) es menor que la presión de triple punto de\(\mathrm{611\ Pa}\) o\(6.03\times {10}^{-3}\ \mathrm{atm}\). Sin embargo, la diferencia es menor que\(1.4\times {10}^{-5}\ \mathrm{atm}\) o\(\mathrm{1.4\ Pa}\). En forma de ecuación, los estados sucesivos atravesados en este ciclo son:
A (hielo a 0 C y 1 atm)\(\mathrm{\to }\)
A* (agua a 0 C y 1 atm)\(\mathrm{\to }\)
B (agua a 100 C y 1 atm)\(\mathrm{\to }\)
B* (vapor de agua a 100 C y 1 atm)\(\mathrm{\to }\)
C (vapor de agua a 100 C y\(P_{sub}\))\(\mathrm{\to }\)
D (vapor de agua a 0 C y\(P_{sub}\))\(\mathrm{\to }\)
D* (hielo a 0 C y\(P_{sub}\))\(\mathrm{\to }\)
A (hielo a 0 C y 1 atm)
Seleccionamos estos pasos porque es experimentalmente sencillo encontrar el cambio de entalpía para todos ellos excepto el paso de sublimación (D*\(\mathrm{\to }\) D). Todos estos pasos se pueden llevar a cabo de manera reversible. Esta estrategia es útil en general. Hacemos un amplio uso de ciclos reversibles para encontrar información termodinámica para sistemas químicos. Los cambios de entalpía para estos pasos son
\(H_2O\)(s, 0 C, 1 atm)\(\mathrm{\to }\)\(H_2O\) (liq, 0 C, 1 atm)\[\Delta H\left(\mathrm{A}\mathrm{\to }{\mathrm{A}}^{\mathrm{*}}\right)={\Delta }_{fus}H\]
\(H_2O\)(liq, 0 C, 1 atm)\(\mathrm{\to }\)\(H_2O\) (liq, 100 C, 1 atm)\[\Delta H\left({\mathrm{A}}^{\mathrm{*}}\mathrm{\to }\mathrm{B}\right)=\int^{372.15\ \mathrm{K}}_{273.15\ \mathrm{K}}{C_P\left(H_2O,\ \mathrm{liq}\right)\ dT}\]
\(H_2O\)(liq, 100 C, 1 atm)\(\mathrm{\to }\)\(H_2O\) (g, 100 C, 1 atm)\[\Delta H\left(\mathrm{B}\mathrm{\to }{\mathrm{B}}^{\mathrm{*}}\right)={\Delta }_{vap}H\]
\(H_2O\)(g, 100 C, 1 atm)\(\mathrm{\to }\)\(H_2O\) (g, 100 C,\(P_{sub}\))\[\Delta H\left({\mathrm{B}}^{\mathrm{*}}\mathrm{\to }\mathrm{C}\right)=\int^{P=P_{sub}}_{P=1}{{\left(\frac{\partial H\left(H_2O,\ \mathrm{g}\right)}{\partial P}\right)}_T\ dP\approx 0}\]
\(H_2O\)(g, 100 C,\(P_{sub}\))\(\mathrm{\to }\)\(H_2O\) (g, 0 C,\(P_{sub}\))\[\Delta H\left(\mathrm{C}\mathrm{\to }\mathrm{D}\right)=\int^{272.15\ \mathrm{K}}_{373.15\ \mathrm{K}}{C_P\left(H_2O,\ \mathrm{g}\right)\ dT}\]
\(H_2O\)(g, 0 C,\(P_{sub}\))\(\mathrm{\to }\)\(H_2O\) (s, 0 C,\(P_{sub}\))\[\Delta H\left(\mathrm{D}\mathrm{\to }{\mathrm{D}}^{\mathrm{*}}\right)={-\Delta }_{sub}H\]
\(H_2O\)(s, 0 C,\(P_{sub}\))\(\mathrm{\to }\)\(H_2O\) (s, 0 C, 1 atm)
\[\Delta H\left({\mathrm{D}}^{\mathrm{*}}\mathrm{\to }\mathrm{A}\right)=\int^{P=1}_{P=P_{sub}}{{\left(\frac{\partial H\left(H_2O,\ \mathrm{s}\right)}{\partial P}\right)}_T\ dP\approx 0}\]Sumando los cambios de entalpía alrededor del ciclo da
\[0={\Delta }_{fus}H+\int^{372.15\ \mathrm{K}}_{273.15\ \mathrm{K}}{C_P\left(H_2O,\ \mathrm{liq}\right)\ dT}+{\Delta }_{vap}H\]\[+\Delta H\left({\mathrm{B}}^{\mathrm{*}}\mathrm{\to }\mathrm{C}\right)+\int^{272.15\ \mathrm{K}}_{373.15\ \mathrm{K}}{C_P\left(H_2O,\ \mathrm{g}\right)\ dT}{-\Delta }_{sub}H\]\[+\Delta H\left({\mathrm{D}}^{\mathrm{*}}\mathrm{\to }\mathrm{A}\right)\]
Utilizando los resultados que encontramos en la siguiente sección,\(H\left({\mathrm{B}}^{\mathrm{*}}\mathrm{\to }\mathrm{C}\right)\approx 0\) y\(\Delta H\left({\mathrm{D}}^{\mathrm{*}}\mathrm{\to }\mathrm{A}\right)\approx 0\), tenemos
\[0={\Delta }_{fus}H+\int^{372.15\ \mathrm{K}}_{273.15\ \mathrm{K}}{C_P\left(H_2O,\ \mathrm{liq}\right)\ dT}+{\Delta }_{vap}H\]\[\ \ +\int^{272.15\ \mathrm{K}}_{373.15\ \mathrm{K}}{C_P\left(H_2O,\ \mathrm{g}\right)\ dT}{-\Delta }_{sub}H\]
La entalpía de fusión, la entalpía de vaporización y las capacidades de calor son medibles en experimentos sencillos. Sus valores se dan en compilaciones estándar, por lo que ahora somos capaces de evaluar\({\Delta }_{sub}H\), una cantidad que no es susceptible de medición directa, a partir de otras cantidades termodinámicas que son. (Ver Problema 8.)


