8.10: Problemas
- Page ID
- 74213
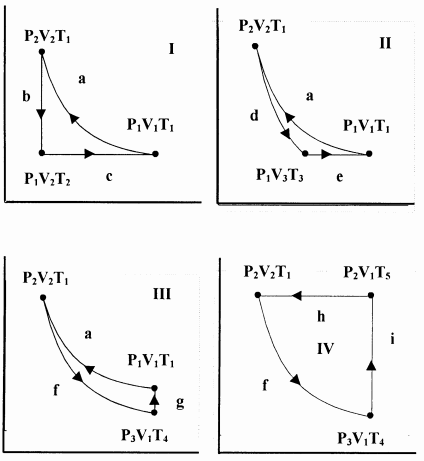
1. Un mol de un gas ideal atraviesa reversiblemente el Ciclo I anterior. El paso a es isotérmico. El paso b es isocórico (volumen constante). El paso c es isobárico (presión constante). Asumir\(C_V\) y\(C_P\) son constantes. Encuentra\(q\),\(w\),\(\Delta E\), y\(\Delta H\) para cada paso y para el ciclo. Demostrar\(C_P=C_V+R\).
2. Un mol de un gas ideal atraviesa reversiblemente el Ciclo II a continuación. El paso a es el mismo proceso isotérmico que en el problema 1. El paso d es adiabático. El paso e es isobárico. Asumir\(C_V\) y\(C_P\) son constantes. Encuentra\(q\),\(w\),\(\Delta E\), y\(\Delta H\) para cada paso y para el ciclo.
3. Un mol de un gas ideal atraviesa reversiblemente el Ciclo III a continuación. La etapa a es el mismo proceso isotérmico que en
problema 1. El paso f es adiabático. El paso g es isocórico. Asumir\(C_V\) y\(C_P\) son constantes. Encuentra\(q\),\(w\),\(\Delta E\), y\(\Delta H\) para cada paso y para el ciclo.
4. Un mol de un gas ideal atraviesa reversiblemente el Ciclo IV. El paso h es isobárico. El paso f es el mismo proceso adiabático que en el problema 3. El paso i es isocórico. Asumir\(C_V\) y\(C_P\) son constantes. Encuentra\(q\),\(w\),\(\Delta E\), y\(\Delta H\) para cada paso y para el ciclo.
5. Demostrar que el trabajo realizado en el sistema es positivo cuando el sistema atraviesa el Ciclo I. Tenga en cuenta que el Ciclo I atraviesa la región del\(PV\) plano que encierra en sentido contrario a las agujas del reloj. Pista: Tenga en cuenta que\(T_2<t_1\). \({V_2}/{V_1}={T_2}/{T_1}\)Demuéstralo.
6. Los ciclos III y IV comparten un paso adiabático común. Expresar el trabajo realizado en cada uno de estos ciclos en términos de\(V_1\),\(V_2\), y\(T_1\). Demostrar que el trabajo realizado en el Ciclo IV es mayor que el trabajo realizado en el Ciclo III.
7. Los ciclos I, II y III comparten un primer paso común, a. Expreso\(V_3\)\(T_3\),, y\(T_4\) en términos de\(V_1\)\(V_2\), y\(T_1\). Para\(V_1=10\ \mathrm{L}\),\(V_2=2\ \mathrm{L}\), y\(T_1=400\ \mathrm{K}\), mostrar que el trabajo realizado disminuye en el orden Ciclo I\(\mathrm{>}\) Ciclo III\(\mathrm{>}\) Ciclo II.
8. Para el agua, las entalpías de fusión y vaporización son\(6.009\) y\(40.657\ \mathrm{k}\mathrm{J}\ {\mathrm{mol}}^{-1}\), respectivamente. La capacidad calorífica del agua líquida varía solo débilmente con la temperatura y se puede tomar como\(\mathrm{75.49\ }\mathrm{J}\ {\mathrm{mol}}^{-1}\ {\mathrm{K}}^{-1}\). La capacidad calorífica del vapor de agua varía con la temperatura:\[C_P\left(H_2O\mathrm{,\ g}\right)=30.51+\left(1.03\times {10}^{-2}\right)T\] donde\(T\) está en grados K y la capacidad calorífica está en\(\mathrm{J}\ {\mathrm{mol}}^{-1}\ {\mathrm{K}}^{-1}\). Estimar la entalpía de sublimación de agua.
9. Si truncamos la ecuación virial\(\left(Z=1+B^*\left(T\right)P+\dots \right)\) y hacemos uso de\(B\left(T\right)=RTB^*\left(T\right)\), donde\(\ B\left(T\right)\) está el “segundo coeficiente virial” más frecuentemente dado en las tablas de datos, el volumen molar es\[\overline{V}=\frac{RT}{P}+B\left(T\right)\] Mostrar que\[{\left(\frac{\partial H}{\partial P}\right)}_T=B\left(T\right)-T\left(\frac{dB}{dT}\right)\]
El Manual de Química y Física (CRC Press, 79\({}^{th}\) Ed., 1999, p. 6-25) da la dependencia de la temperatura de\(B\) para el vapor de agua como
\[B=-1158-5157t-10301t^2-10597t^3-4415t^4\]
donde\(t=\left({298.15}/{T}\right)-1\),\(T\) está en grados kelvin, y las unidades de\(B\) son\({\mathrm{cm}}^{-3\ }{\mathrm{mol}}^{-1}\). Estimar el cambio de entalpía cuando un mol de vapor de agua a 1 atm y 100 C se expande a la presión de sublimación de equilibrio, que para ello podemos aproximarnos como la presión de triple punto,\(610\ \mathrm{Pa}\). ¿Cómo se compara este valor con el resultado del problema 8?
10. Las capacidades caloríficas del metanol líquido y gas son\(81.1\) y\(44.1\ \mathrm{J}\ {\mathrm{mol}}^{-1}\ {\mathrm{K}}^{-1}\), respectivamente. El segundo coeficiente de virio para el vapor de metanol es
\[B=-1752-4694t\]
donde\(t=\left({298.15}/{T}\right)-1\),\(T\) está en grados kelvin, y las unidades de\(B\) son\({\mathrm{cm}}^{-3\ }{\mathrm{mol}}^{-1}\). Refiriéndose a la discusión de vaporización de metanol en § 5, calcular\({\Delta }_{\left(1\right)}H\),\({\Delta }_{\left(4\right)}H\),\({\Delta }_{\left(5\right)}H\),\({\Delta }_{\left(vap\right)}H^o\). Compare este valor de\({\Delta }_{\left(vap\right)}H^o\) con el valor dado en el texto. [Datos del Manual de Química y Física, CRC Press, 79\({}^{th}\) Ed., 1999, p. 5 -27 y p. 6-31.]
| Fórmula molecular | Nombre | \({\Delta }_fH^o\)\(\left(\mathrm{k}\mathrm{J}\ {\mathrm{mol}}^{-1}\right)\) |
| \(H_2O\ \left(\mathrm{liq}\right)\) | Agua | \(-285.8\) |
| \(CO\ \left(\mathrm{g}\right)\) | Monóxido de carbono | \(-110.5\) |
| \(CO_2\ \left(\mathrm{g}\right)\) | Dióxido de carbono | \(-393.5\) |
| \(CH_4\left(\mathrm{g}\right)\) | Metano | \(-74.6\) |
| \(C_2H_4\left(\mathrm{g}\right)\) | Etileno | \(52.4\) |
| \(C_2H_6\left(\mathrm{g}\right)\) | Etanos | \(-84.0\) |
| \(CH_3CH_2OH\ \left(\mathrm{liq}\right)\) | Etanol | \(-277.6\) |
| \(CH_3CHO\ \left(\mathrm{liq}\right)\) | Acetaldehído | \(-192.2\) |
| \(CH_3CO_2H\ \left(\mathrm{liq}\right)\) | Ácido acético | \(-484.3\) |
| \(CH_3CH_2CHO\ \left(\mathrm{liq}\right)\) | Propropanal | \(-215.6\) |
| \(C_6H_6\ \left(\mathrm{liq}\right)\) | Benceno | \(49.1\) |
| \(C_6H_5CO_2H\ \left(\mathrm{s}\right)\) | Ácido benzoico | \(-385.2\) |
11. Utilizando los datos de la tabla anterior, encuentra el cambio de entalpía para cada una de las siguientes reacciones a 298 K.
(a)\(C_2H_6\left(\mathrm{g}\right)+Callstack:
at (Quimica/Química_Física_y_Teórica/Libro:_Termodinámica_y_Equilibrio_Químico_(Ellgen)/08:_Entalpía_y_Ciclos_Termoquímicos/8.10:_Problemas), /content/body/p[19]/span/span, line 1, column 1
b)\(C_2H_4\left(\mathrm{g}\right)+Callstack:
at (Quimica/Química_Física_y_Teórica/Libro:_Termodinámica_y_Equilibrio_Químico_(Ellgen)/08:_Entalpía_y_Ciclos_Termoquímicos/8.10:_Problemas), /content/body/p[20]/span/span, line 1, column 1
c)\(C_2H_6\left(\mathrm{g}\right)+Callstack:
at (Quimica/Química_Física_y_Teórica/Libro:_Termodinámica_y_Equilibrio_Químico_(Ellgen)/08:_Entalpía_y_Ciclos_Termoquímicos/8.10:_Problemas), /content/body/p[21]/span/span, line 1, column 1
d)\(C_6H_6\left(\mathrm{liq}\right)+\ CO_2\left(\mathrm{g}\right)\to C_6H_5CO_2H\left(\mathrm{s}\right)\)
(e)\(CH_3CHO\left(\mathrm{liq}\right)+Callstack:
at (Quimica/Química_Física_y_Teórica/Libro:_Termodinámica_y_Equilibrio_Químico_(Ellgen)/08:_Entalpía_y_Ciclos_Termoquímicos/8.10:_Problemas), /content/body/p[23]/span/span, line 1, column 1
f)\(CH_4\left(\mathrm{g}\right)+H_2O\left(\mathrm{liq}\right)\to CO\left(\mathrm{g}\right)+3\ H_2\left(\mathrm{g}\right)\)
g)\(CH_4\left(\mathrm{g}\right)+H_2O\left(\mathrm{liq}\right)+Callstack:
at (Quimica/Química_Física_y_Teórica/Libro:_Termodinámica_y_Equilibrio_Químico_(Ellgen)/08:_Entalpía_y_Ciclos_Termoquímicos/8.10:_Problemas), /content/body/p[25]/span/span, line 1, column 1
h)\(C_2H_4\left(\mathrm{g}\right)+CO\left(\mathrm{g}\right)+\ H_2\left(\mathrm{g}\right)\to CH_3CH_2CHO\left(\mathrm{liq}\right)\)
Notas
\(^{1}\)Datos compilados por El Comité de Datos para la Ciencia y la Tecnología (CODATA) y reimpresos en D. R. Linde, Editor, The Handbook of Chemistry and Physics, 79\({}^{th}\) Edición (1998-1999), CRC Press, Sección 5.
\({}^{2}\)D. R. Linde, op. cit. , p. 6 -104.


