9.1: La Segunda Ley de la Termodinámica
- Page ID
- 74279
La primera ley de la termodinámica se refiere a la energía y sus propiedades. Como vimos en el Capítulo 7, la primera ley surgió de la observación de que la disipación del trabajo mecánico a través de la fricción crea calor. En una síntesis que fue en parte definición y en parte una generalización a partir de la experiencia, se propuso que la energía mecánica y el calor son manifestaciones de una cantidad común, la energía. Posteriormente, por mayor definición y generalización, el concepto se amplió para incluir otras formas de energía. El concepto de energía evolucionó hacia el prescripto de que existe una cantidad (función de estado) que se conserva a través de cualquier forma de cambio.
El elemento de definición surge del hecho de que reconocemos nuevas formas de energía siempre que sea necesario para garantizar que se cumpla la condición de conservación. El elemento de experiencia surge del hecho de que este prescripto ha dado como resultado un cuerpo de teoría y un cuerpo de resultados experimentales que son mutuamente compatibles. Cuando definimos y medimos la energía “correctamente”, efectivamente encontramos que la energía es una función de estado y que se conserva.
La teoría de la relatividad introdujo una expansión significativa del concepto energético. Para los procesos químicos, podemos ver la conservación de masa y energía como postulados independientes. Para los procesos en los que las partículas fundamentales sufren cambios y para los sistemas que se mueven a velocidades cercanas a la de la luz, no podemos. La relatividad afirma que la energía de una partícula viene dada por la ecuación de Einstein,
\[E^2=p^2c^2+m^2_0c^4.\]
En esta ecuación,\(E\) está la energía de las partículas,\(p\) es su impulso,\(m_0\) es su masa de reposo, y\(c\) es la velocidad de la luz. En las transformaciones de partículas fundamentales en las que la suma de las masas de reposo de las partículas de producto es menor que la de las partículas reaccionantes, la conservación de energía requiere que la suma de los momentos de las partículas de producto supere a la de las partículas reaccionantes. El aumento de impulso significa que las partículas del producto tienen altas velocidades, lo que corresponde a una temperatura alta para el sistema de producto. La expresión más famosa de este resultado es aquella\(E=m_0c^2\), es decir, que podemos asociar esta cantidad de energía con la masa,\(m_0\), de una partícula estacionaria, para la cual\(p=0\).
La situación con respecto a la segunda ley es similar. A partir de la experiencia con dispositivos que convierten el calor en trabajo, la idea evolucionó de que dichos dispositivos deben tener propiedades particulares. La consideración de estas propiedades llevó al descubrimiento de una nueva función de estado, a la que llamamos entropía, y a la que habitualmente asignamos el símbolo “\(S\)”. Introducimos las leyes de la termodinámica en § 6-13. Repetimos aquí nuestra declaración de la segunda ley:
La Segunda Ley de la Termodinámica
En un proceso reversible en el que un sistema cerrado acepta un incremento de calor,\(\boldsymbol{d}\boldsymbol{q}^\boldsymbol{rev}\), desde su entorno, el cambio en la entropía del sistema,\(\boldsymbol{dS}\), es\(\boldsymbol{dS}\boldsymbol{=}\boldsymbol{dq}^\boldsymbol{rev}/\boldsymbol{T}\). La entropía es una función de estado. Para cualquier proceso reversible,\(\boldsymbol{dS}_\boldsymbol{universe}\boldsymbol{=}\boldsymbol{0}\), y a la inversa. Para cualquier proceso espontáneo,\(\boldsymbol{dS}_\boldsymbol{universe}\boldsymbol{>}\boldsymbol{0}\), y a la inversa.
Si un proceso espontáneo lleva un sistema del estado A al estado B, el estado B puede ser o no un estado de equilibrio. El Estado A no puede ser un estado de equilibrio. Como no podemos usar la ecuación definitoria para encontrar el cambio de entropía para un proceso espontáneo, debemos usar algún otro método si queremos estimar el valor del cambio de entropía. Esto significa que debemos tener ya sea un modelo matemático empírico a partir del cual podamos estimar la entropía de un estado de no equilibrio o un sistema de equilibrio que sea un buen modelo para el estado inicial del proceso espontáneo.
Por lo general, podemos encontrar un sistema de equilibrio que sea un buen modelo para el estado inicial de un proceso espontáneo. Por lo general, alguna alteración de un sistema de equilibrio hace posible el cambio espontáneo. El estado habilitado para el cambio es el estado inicial para un proceso espontáneo, pero sus funciones de estado termodinámico son esencialmente idénticas a las del estado de equilibrio previo a la alteración. Por ejemplo, supongamos que una solución contiene los reactivos y productos para alguna reacción que se produce sólo en presencia de un catalizador. En este caso, la solución puede estar efectivamente en equilibrio incluso cuando la composición no corresponde a una posición de equilibrio de la reacción. (En un esfuerzo por ser más precisos, podemos denominar a esto un estado de cuasi-equilibrio, con lo que queremos decir que el sistema es inmutable aunque sea posible un cambio espontáneo). Si introducimos una cantidad muy pequeña de catalizador, y consideramos el estado del sistema antes de que ocurra alguna reacción, todas las funciones de estado que caracterizan al sistema deben estar esencialmente inalteradas. Sin embargo, tan pronto como se introduce el catalizador, el sistema ya no puede considerarse en estado de equilibrio. La reacción espontánea procede hasta alcanzar el equilibrio. Podemos encontrar el cambio de entropía para el proceso espontáneo al encontrar el cambio de entropía para un proceso reversible que lleva el estado inicial, precatalizador, cuasi-equilibrio al estado de equilibrio final, post-catalizador.
Nuestra declaración de la segunda ley establece las propiedades de la entropía por postulado. Si bien este enfoque es rigurosamente lógico, no nos ayuda a entender las ideas involucradas. Al igual que la primera ley, la segunda ley se puede afirmar de varias maneras. Para desarrollar nuestra comprensión de la entropía y sus propiedades, es útil volver a considerar una afirmación más tradicional de la segunda ley:
Una declaración tradicional de la segunda ley
Es imposible construir una máquina que opere en un ciclo, intercambie calor con su entorno a una sola temperatura y produzca trabajo en el entorno.
Cuando introducimos la calificación de que la máquina “intercambia calor con su entorno a una sola temperatura”, queremos decir que la temperatura del entorno tiene un valor particular cada vez que la máquina y el entorno intercambian calor. El comunicado no coloca ninguna condición sobre la temperatura de la máquina en ningún momento.
En este capítulo, tenemos ocasión frecuente de referirnos a cada una de estas declaraciones. Para no confundirlos, nos referiremos a nuestro enunciado de la segunda ley como el enunciado basado en entropía. Nos referiremos al enunciado anterior como el enunciado basado en máquinas de la segunda ley.
Por “una máquina” nos referimos a un motor térmico, un dispositivo que acepta calor y produce trabajo mecánico. Esta afirmación afirma que una “máquina de movimiento perpetuo de segundo tipo” no puede existir. Tal máquina acepta energía térmica y la convierte toda en trabajo, mientras que ella misma regresa al mismo estado al final de cada ciclo. (En el § 7-11, observamos que una “máquina de movimiento perpetuo de primer tipo” es aquella cuyo funcionamiento viola el principio de conservación de la energía.) Normalmente, consideramos esta afirmación como un postulado. Consideramos que lo inferimos de la experiencia. A diferencia de nuestras afirmaciones sobre la entropía, que son totalmente abstractas, esta afirmación hace una aseveración sobre máquinas reales del tipo que encontramos en la vida cotidiana. Podemos entender la aseveración que hace en términos concretos: Una máquina que pudiera convertir calor de una fuente de temperatura constante en trabajo podría extraer calor del agua helada, produciendo cubitos de hielo en el agua y una cantidad equivalente de trabajo en otros lugares del entorno. Esta máquina no intercambiaría calor con ningún otro depósito de calor. Nuestra declaración basada en máquinas de la segunda ley postula que tal máquina no puede existir.
Nuestra declaración basada en entropía de la segunda ley surgió de pensar en las propiedades de las máquinas que sí convierten el calor en trabajo. Rastreamos este pensamiento para ver cómo se desarrolló nuestra declaración basada en entropía de la segunda ley. Comprender este desarrollo nos da una mejor apreciación del significado de la entropía. Encontramos que debemos complementar la declaración basada en máquina de la segunda ley con supuestos adicionales para llegar a todas las propiedades de la función de entropía que se aseveran en la declaración basada en entropía.
Sin embargo, antes de comprometernos a desarrollar la declaración basada en entropía de la segunda ley a partir de la declaración basada en máquina, desarrollemos lo contrario; es decir, mostremos que la declaración basada en máquina es una consecuencia lógica de la declaración basada en entropía. Para ello, asumimos que es posible una máquina de movimiento perpetuo de segundo tipo. Para ayudar a mantener nuestro argumento claro, deja que la proposición\(\mathrm{MSL}\) sea la declaración basada en máquina. Estamos asumiendo que la proposición\(\mathrm{MSL}\) es falsa, así que esa proposición\(\sim \mathrm{MSL}\) es verdadera. Dejamos\(\mathrm{SL}\) ser la declaración basada en entropía de la segunda ley.
El boceto de la Figura 1 describe la interacción de esta máquina de movimiento perpetuo\(\mathrm{PPM}\), con su entorno. A partir de nuestra declaración basada en entropía de la segunda ley, podemos afirmar algunos hechos importantes sobre los cambios de entropía que acompañan al funcionamiento de la máquina. Dado que la entropía es una función de estado,\(\Delta S=0\) para un ciclo de la máquina. Si la máquina funciona (es decir,\(\sim \mathrm{MSL}\) es verdad), entonces la declaración basada en entropía lo requiere\(\Delta S_{universe}=\Delta S+\Delta \hat{S}\ge 0\). Ya que\(\Delta S=0\), se deduce que\(\Delta \hat{S}\ge 0\). Podemos hacer esto más explícito escribiendo:\(\left(\mathrm{SL\ and}\ \sim \mathrm{MSL}\right)\Rightarrow \Delta \hat{S}\ge 0\).
La declaración basada en máquinas de la segunda ley también nos permite determinar el cambio de entropía en el entorno a partir de nuestra definición de entropía de segunda ley. En un ciclo, esta máquina (sistema) entrega trabajo neto\(\hat{w}>0\),, al entorno; acepta una cantidad neta de calor,\(q>0\), del entorno, que están a temperatura,\(\hat{T}\). Simultáneamente, los alrededores entregan una cantidad de calor\(\hat{q}\),, dónde\(\hat{q}=-q\), y\(\hat{q}<0\). El cambio que se produce en un ciclo de la máquina no necesita ser reversible. Sin embargo, si el cambio es reversible o no, todo el cambio térmico en el entorno consiste en el intercambio de una cantidad de calor,\(\hat{q}<0\), por un depósito de temperatura constante a\(\hat{T}\). Podemos efectuar idénticamente el mismo cambio en el entorno usando algún otro proceso para extraer reversiblemente esta cantidad de calor. El cambio de entropía en el entorno en este proceso reversible será\({\hat{q}}/{\hat{T}}\), y este será el mismo que el cambio de entropía para el entorno en un ciclo de la máquina. (Consideramos esta conclusión más adelante en el § 15.) De ello se deduce\(\Delta \hat{S}={\hat{q}}/{\hat{T}}\), y desde\(\hat{q}<0\)\(\hat{T}>0\), mientras, tenemos\(\Delta \hat{S}<0\). Podemos escribir esta conclusión de manera más explícita:\(\left(\mathrm{SL\ and}\ \sim \mathrm{MSL}\right)\Rightarrow \Delta \hat{S}<0\).
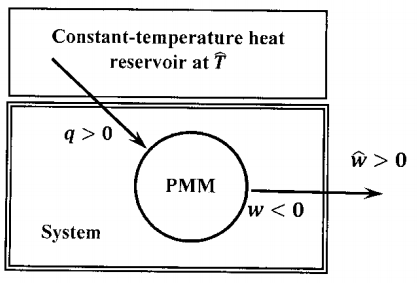
Al asumir que es posible una máquina de movimiento perpetuo del segundo tipo —es decir, asumiendo que\(\sim \mathrm{MSL}\) es verdad— derivamos la contradicción de que ambos\(\Delta \hat{S}\ge 0\) y\(\Delta \hat{S}<0\). Por lo tanto, la proposición\(\sim \mathrm{MSL}\) debe ser falsa. La proposición\(\mathrm{MSL}\) debe ser cierta. La segunda ley de la termodinámica basada en entropía implica que no es posible una máquina de movimiento perpetuo de segundo tipo. Es decir, la declaración basada en entropía de la segunda ley implica la afirmación basada en máquinas. (Eso lo demostramos\(\sim \left(\mathrm{SL\ and}\ \sim \mathrm{MSL}\right)\); de ello se deduce\(\mathrm{SL\ }\mathrm{\Rightarrow }\mathrm{MSL}\). Para un argumento más detallado, ver problema 2.)


