12.10: Problemas
- Page ID
- 74433
1. Para cualquier cambio en un sistema reversible, tenemos\(dG=-SdT+VdP\). Considere dos sistemas,\(\alpha\) y\(\beta\), donde el sistema se\(\alpha\) puede convertir en sistema\(\beta\). (A continuación, dejaremos\(\alpha\) y\(\beta\) seremos las fases sólida y líquida de la misma sustancia pura, pero esto no es una restricción necesaria). Para los cambios incrementales de temperatura y presión, representados por\(dT\) y\(dP\), tenemos
\[dG_{\alpha }=V_{\alpha }dP-S_{\alpha }dT\]y\(dG_{\beta }=V_{\beta }dP-S_{\beta }dT\)
Podemos restar para encontrar
\[d\left(G_{\beta }-G_{\alpha }\right)=\left(V_{\beta }-V_{\alpha }\right)dP-\left(S_{\beta }-S_{\alpha }\right)dT\]o\[d\left({\Delta }_{\alpha \to \beta }G\right)=\left({\Delta }_{\alpha \to \beta }V\right)dP-\left({\Delta }_{\alpha \to \beta }S\right)dT\]
que solemos escribir como
\[d\left(\Delta G\right)=\Delta VdP-\Delta SdT\]
Aquí\({\Delta }_{\alpha \to \beta }X\) (o\(\Delta X\)) está el cambio en la función de estado\(X\) que ocurre cuando el sistema\(\alpha\) se convierte en sistema\(\beta\). Para muchos sistemas interconvertibles, es una buena aproximación decir que\({\Delta }_{\alpha \to \beta }S\) (o\(\Delta S\)) y\({\Delta }_{\alpha \to \beta }V\) (o\(\Delta V\)) son constantes para cambios modestos de temperatura o presión. Entonces, representando la presión y temperatura en los estados inicial y final como\(\left(P_1,T_1\right)\) y\(\left(P_2,T_2\right)\), respectivamente, el cambio en\({\Delta }_{\alpha \to \beta }G\) (o\(\Delta G\)) se puede obtener por integración:
\[\int^{P_2,T_2}_{P_1,T_1}{d\left(\Delta G\right)=-\Delta S\int^{T_2}_{T_1}{dT}+\Delta V\int^{P_2}_{P_1}{dP}}\]o\[\Delta \left(\Delta G\right)=\Delta G\left(P_2,T_2\right)-\Delta G\left(P_1,T_1\right)=-\Delta S\left(T_2-T_1\right)+\Delta V\left(P_2-P_1\right)\]
Tenga en cuenta que\(\alpha\) y no es\(\beta\) necesario que estén en equilibrio entre sí ni en la condición especificada por\(\left(P_1,T_1\right)\) ni en la especificada por\(\left(P_2,T_2\right)\).
Sin embargo, en el importante caso especial que\(\boldsymbol{\alpha }\) y\(\boldsymbol{\beta }\) están en equilibrio en\(\left({\boldsymbol{P}}_{\boldsymbol{1}},{\boldsymbol{T}}_{\boldsymbol{1}}\right)\), tenemos\({\boldsymbol{\Delta }}_{\boldsymbol{\alpha }\boldsymbol{\to }\boldsymbol{\beta }}\boldsymbol{G}\left({\boldsymbol{P}}_{\boldsymbol{1}},{\boldsymbol{T}}_{\boldsymbol{1}}\right)\boldsymbol{=}\boldsymbol{\Delta }\boldsymbol{G}\left({\boldsymbol{P}}_{\boldsymbol{1}},{\boldsymbol{T}}_{\boldsymbol{1}}\right)\boldsymbol{=}\boldsymbol{0}\). Entonces
\[\Delta \left(\Delta G\right)=\Delta G\left(P_2,T_2\right)=-\Delta S\left(T_2-T_1\right)+\Delta V\left(P_2-P_1\right)\]
Considerar la aplicación de estas observaciones al caso donde\(\alpha\) y\(\beta\) son metal de aluminio sólido y líquido, respectivamente. A una barra, el aluminio se funde a 933.47 K. En el punto de fusión, la entalpía de fusión es\({\Delta }_{fus}\overline{H}=+10.71\ \mathrm{kJ}\ {\mathrm{mol}}^{-1}\). El peso atómico del aluminio es\(26.9815\ \mathrm{g}\ {\mathrm{mol}}^{-1}\). La densidad del aluminio líquido en el punto de fusión es\(2.375\ \mathrm{g}\ {\mathrm{cm}}^{-1}\); el volumen molar del líquido es por lo tanto\(1.1361\times {10}^{-5}\ {\mathrm{m}}^3\ {\mathrm{mol}}^{-1}\). A 20 C, la densidad del aluminio sólido es\(2.70\ \mathrm{g}\ {\mathrm{cm}}^{-1}\), y el volumen molar es\(0.9993\times {10}^{-5}\ {\mathrm{m}}^3\ {\mathrm{mol}}^{-1}\). Suponiendo que el volumen molar del sólido sea independiente de la temperatura, el cambio en el volumen molar que se produce cuando el aluminio se funde es\({\Delta }_{fus}\overline{V}=1.368\times {10}^{-6}\ {\mathrm{m}}^3\ {\mathrm{mol}}^{-1}\).
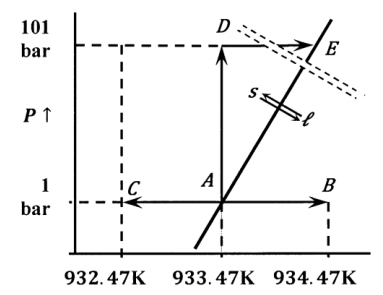
a) ¿Qué hay\({\Delta }_{fus}\overline{V}\) en el punto de fusión a una barra (punto A en el diagrama)?
b) ¿Es la conversión de aluminio sólido a aluminio líquido un proceso reversible, espontáneo o imposible a (933.47 K, 1 bar), es decir, en el punto A?
c) ¿Qué hay\({\Delta }_{fus}\overline{S}\) en el punto de fusión en una barra, es decir, en el punto A?
d) ¿Qué es\(\Delta \left({\Delta }_{fus}\overline{G}\right)\) cuando la presión y la temperatura van de (933.47 K, 1 bar) a (934.47 K, 1 bar)? (Es decir, del punto A al punto B en el diagrama.) ¿Qué está\({\Delta }_{fus}\overline{G}\) en (934.47 K, 1 bar)?
e) ¿Es la conversión de aluminio sólido a aluminio líquido un proceso reversible, espontáneo o imposible a (934.47 K, 1 bar), es decir, en el punto B?
(f) ¿Qué es\(\Delta \left({\Delta }_{fus}\overline{G}\right)\) cuando la presión y la temperatura van de (933.47 K, 1 bar) a (932.47 K, 1 bar)? (Es decir, del punto A al punto C en el diagrama.) ¿Qué está\({\Delta }_{fus}\overline{G}\) en (932.47 K, 1 bar)?
(g) ¿Es la conversión de aluminio sólido a aluminio líquido un proceso reversible, espontáneo o imposible a (932.47 K, 1 bar), es decir, en el punto C?
(h) ¿Qué es\(\Delta \left({\Delta }_{fus}\overline{G}\right)\) cuando la presión y la temperatura van de (933.47 K, 1 bar) a (933.47 K, 101 bar)? (Es decir, del punto A al punto D en el diagrama.) ¿Qué está\({\Delta }_{fus}\overline{G}\) en (933.47 K, 101 bar)?
(i) ¿Es la conversión de aluminio sólido a aluminio líquido un proceso reversible, espontáneo o imposible a (933.47 K, 101 bar), es decir, en el punto D?
(j) Si mantenemos la presión constante a 101 bar, ¿cuánto tendríamos que cambiar la temperatura para simplemente compensar el cambio en\(\Delta \left({\Delta }_{fus}\overline{G}\right)\) que ocurrió en la parte h? Tenga en cuenta que este cambio alcanzará las condiciones representadas por el punto E en el diagrama
k) ¿La conversión de aluminio sólido a aluminio líquido es un proceso reversible, espontáneo o imposible en el punto E?
(l) ¿Qué hay\(\Delta \left({\Delta }_{fus}\overline{G}\right)\) al pasar del punto D (933.47 K, 101 bar) al punto B (934.47 K, 1 bar)? ¿Este valor es igual a la diferencia entre la energía libre de Gibbs de un mol de aluminio líquido en el punto B y un mol de aluminio sólido en el punto D?
2. En el intervalo de temperatura\(0.01>t>-10\ \mathrm{C}\), la presión de vapor del agua (en Pa) por encima del hielo puro se aproxima por\({ \ln P\ }=a+bt+ct^2\)\(a=6.41532\), donde\(b=8.229\times {10}^{-2}\),\(c=-3.2\times {10}^{-4}\),\(t=T-273.15\),, y\(T\) es la temperatura en grados Kelvin. Estimar la entalpía de sublimación de hielo en\(273.15\ \mathrm{K}\).
3. En el intervalo de temperatura\(373.15>T>273.15\ \mathrm{K}\), la presión de vapor del agua (en Pa) se aproxima por\({ \ln P\ }=a+bt+ct^2+dt^3+et^4\), donde\(a=9.42095\)\(b=4.960\times {10}^{-2}\),\(c=-1.7536\times {10}^{-4}\),\(d=6.02\times {10}^{-7}\),\(e=-2.0\times {10}^{-9}\),\(t=T-323.15\),, y\(T\) es la temperatura en grados Kelvin. Estimar la entalpía de vaporización del agua a 323.15 K y 373.15 K.
4. El punto de ebullición normal (1 atm) de la acetona es 56.05 C. La entalpía de vaporización en el punto de ebullición normal es\(29.10\ \mathrm{kJ}\ {\mathrm{mol}}^{-1}\). ¿Cuál es la entropía de vaporización de acetona en el punto de ebullición normal? Estimar la presión de vapor de acetona a 25.0 C.
5. Dos formas alotrópicas de estaño, estaño gris y estaño blanco, están en equilibrio a 13.2 C y 1 atm. La densidad del estaño gris es\(5.769\ \mathrm{g}\ {\mathrm{cm}}^{-1}\); la densidad del estaño blanco es 7.265\(\ \mathrm{g}\ {\mathrm{cm}}^{-1}\). Supongamos que las densidades son independientes de la temperatura. A 298.15 K y 1 bar,\(S^o\) y\(C_P\) para estaño gris son\(44.1\mathrm{\ J}\ {\mathrm{mol}}^{-1}\ {\mathrm{K}}^{-1}\) y\(25.8\mathrm{\ J}\ {\mathrm{mol}}^{-1}\ {\mathrm{K}}^{-1}\), respectivamente. Para estaño blanco,\(S^o\) y\(C_P\) son\(51.2\mathrm{\ J}\ {\mathrm{mol}}^{-1}\ {\mathrm{K}}^{-1}\) y\(27.0\mathrm{\ J}\ {\mathrm{mol}}^{-1}\ {\mathrm{K}}^{-1}\), respectivamente. Estimar\(\Delta \overline{S}\) y\(\Delta \overline{V}\) para la conversión de estaño gris a estaño blanco a 13.2 C. ¿A qué temperatura están el estaño gris y el estaño blanco en equilibrio a una presión de 100 atm?
6. A 1000K, las energías libres de Gibbs estándar de formación de grafito y diamante son 0.000 y\(+5.905\ \mathrm{kJ}\ {\mathrm{mol}}^{-1}\), respectivamente. A 298.15 K y 1.000 bar, los volúmenes molares de grafito y diamante son\(5.46\times {10}^{-6\ }{\mathrm{m}}^3\ {\mathrm{mol}}^{-1}\) y\(3.42\times {10}^{-6\ }{\mathrm{m}}^3\ {\mathrm{mol}}^{-1}\), respectivamente. \(P^{\#}\)Sea la presión a la que el grafito y el diamante están en equilibrio a 1000 K.
(a) Cuál es el valor de\(\Delta \overline{G}\) for
\[C\left(\mathrm{graphite}, 1\ \mathrm{bar},\ 1000\mathrm{K}\right)\to C\left(\mathrm{diamond},\ 1\ \mathrm{bar},\ 1000\mathrm{K}\right)?\]
(b) Expreso\(\Delta \overline{G}\) para
\[C\left(\mathrm{graphite},\ 1\ \mathrm{bar},\ 1000\mathrm{K}\right)\to C\left(\mathrm{graphite},\ P^{\#},\ 1000\mathrm{K}\right)\]
en función de\(P^{\#}\).
(c) Expreso\(\Delta \overline{G}\) para
\[C\left(\mathrm{diamond},\ 1\ \mathrm{bar},\ 1000\mathrm{K}\right)\to C\left(\mathrm{diamond},\ P^{\#},\ 1000\mathrm{K}\right)\]
en función de\(P^{\#}\).
d) Cuál es el valor de\(\Delta \overline{G}\) for
\[C\left(\mathrm{graphite},\ P^{\#},\ 1000\mathrm{K}\right)\to C\left(\mathrm{diamond},\ P^{\#},\ 1000\mathrm{K}\right)?\]
e) Supongamos que los volúmenes molares son independientes de la presión y la temperatura. Estimar el valor de la presión de equilibrio,\(P^{\#}\).
Notas
Véase Robert Bruce Lindsay y Henry Margenau, Fundamentos de la Física, Dover Publications, Inc., Nueva York, 1963, p. 195.


