16.1: Soluciones cuyos componentes están en equilibrio con sus propios gases
- Page ID
- 74113
Una forma de encontrar actividades es encontrar la composición y presión de la fase gaseosa que está en equilibrio con la solución. Si los gases no son ideales, también necesitamos datos experimentales sobre los volúmenes molares parciales de los componentes en la fase gaseosa. La recolección de estos datos es factible para soluciones de líquidos moleculares volátiles. Para soluciones de electrolitos u otros componentes no volátiles, se requieren otros métodos.
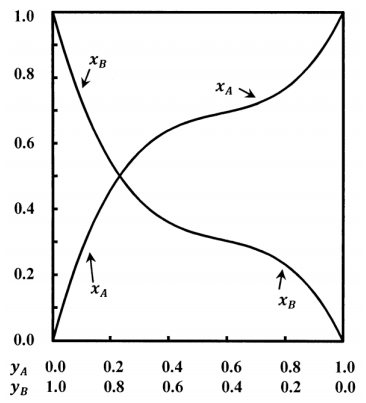
Las curvas esbozadas en la Figura 1 describen un sistema que contiene componentes\(A\) y\(B\). Las fracciones molares en la solución y las fracciones molares en el gas están relacionadas de manera no lineal. Dejar que las fracciones molares en el gas sean\(x_A\) y\(x_B\); dejar que las de la solución sean\(y_A\) y\(y_B\). Tenemos\(x_A+x_B=1\) y\(y_A+y_B=1\). En equilibrio, ambas fases están a la misma presión,\(P\).
Imaginamos obtener los datos que necesitamos sobre este sistema preparando muchas mezclas de\(A\) y\(B\). Comenzando con un sistema completamente líquido a cierta presión aplicada, disminuimos lentamente la presión aplicada hasta que la presión aplicada se vuelve igual a la presión de equilibrio\(P\), y el líquido comienza a vaporizarse. La Figura 2 muestra esquemáticamente este sistema.
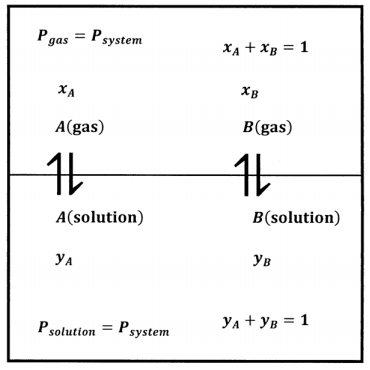
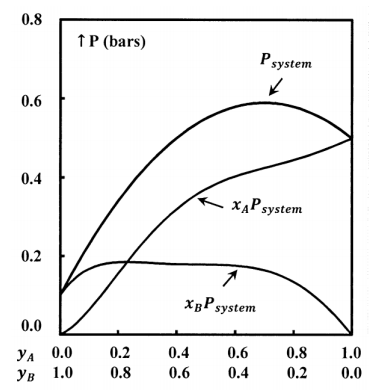
Determinamos las composiciones de las fases gaseosa y líquida por análisis químico; para cada sistema, determinamos\(P\),\(x_A\),\(x_B\),\(y_A\), y\(y_B\). A partir de estos datos podemos desarrollar ecuaciones empíricas que expresan\(P\)\(x_A\),, y\(x_B\) como funciones de\(y_A\); es decir, tenemos\(P=P\left(y_A\right)\),\(x_A=x_A\left(y_A\right)\), y\(x_B=x_B\left(y_A\right)\). Por último, podemos encontrar el valor de los productos\(x_AP\) y\(x_BP\). La Figura 3 ilustra una posible función\(P=P\left(y_A\right)\) y los productos\(x_AP\), y\(x_BP\), cuando las fracciones molares en fase gaseosa dependen de\(y_A\) como se muestra en la Figura 1.
Con el hipotético estado estándar de gas ideal como estado estándar para\(A\) la fase gaseosa, vemos en la Sección 14.11 que el potencial químico de\(A\) en la fase gaseosa es
\[{\mu }_A\left(g,P,x_A,x_B\right)={\Delta }_fG^o\left(A,{HIG}^o\right)+RT{ \ln \left[\frac{x_AP}{P^o}\right]+RT\int^P_0{\left(\frac{{\overline{V}}_A\left(g\right)}{RT}-\frac{1}{P}\right)}\ }dP\](cualquier gas; el estado estándar de actividad es HIG\({}^{o}\))
donde\({\overline{V}}_A\left(g\right)\) es el volumen molar parcial y\(x_A\) es la fracción molar de\(A\) en la mezcla gaseosa. La fugacidad y actividad de\(A\) en la fase gaseosa están dadas por
\[{ \ln \left[{\tilde{a}}_A,P,x_A,x_B\right]\ }={ \ln \left[\frac{f_A\left(g,P,x_A,x_B\right)}{f_A\left({HIG}^o\right)}\right]\ }={ \ln \left[\frac{x_AP}{P^o}\right]+\int^P_0{\left(\frac{{\overline{V}}_A\left(g\right)}{RT}-\frac{1}{P}\right)}\ }dP\]
y el potencial químico de estado estándar es
\[{\mu }^o_A={\Delta }_fG^o\left(A,{HIG}^o\right)\]
Queremos expresar el potencial químico de\(A\) en la solución líquida utilizando las propiedades de la solución. Para ello, se introduce la actividad química del componente\(A\). Escribimos\({\tilde{a}}_A\left(P,y_A,y_B\right)\) para representar la actividad de\(A\) en una solución a presión\(P\) y en la que la composición se especifica por las fracciones molares\(y_A\) y\(y_B\). Si se ajusta a nuestros propósitos, somos libres de elegir un estado estándar para la actividad de\(A\) en la solución líquida que sea diferente al estado estándar que elegimos para\(A\) la fase gaseosa. Por razones que se hacen evidentes a continuación, a menudo es útil elegir el estado estándar para que la actividad de\(A\) en la solución líquida sea líquido puro\(A\) a su presión de vapor de equilibrio,\(P^{\textrm{⦁}}_A\). Representamos el potencial químico de\(A\) en este estado estándar por\({\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)\). Tenga en cuenta que este estado no es idéntico al estado estándar para el líquido puro, para el cual la presión es de una bar y el potencial químico es\({\Delta }_fG^o\left(A,\ell \right)\). El potencial químico y la actividad de A en la solución están relacionados por
\[{\mu }_A\left(P,y_A,y_B\right)={\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)+RT{ \ln \left[{\tilde{a}}_A\left(P,y_A,y_B\right)\right]\ }\](cualquier solución; el estado estándar de actividad para\(A\) en solución es líquido puro\(A\) a su presión de vapor de equilibrio)
Como el sistema está en equilibrio, tenemos
\[{\mu }_A\left(g,P,x_A,x_B\right)={\mu }_A\left(P,y_A,y_B\right)\]
Igualando nuestras ecuaciones para estas cantidades, encontramos
\[{ \ln \left[{\tilde{a}}_A\left(P,y_A,y_B\right)\right]\ }=\frac{{\Delta }_fG^o\left(A,{HIG}^o\right)-{\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)}{RT}+{ \ln \left[\frac{x_AP}{P^o}\right]+\int^P_0{\left(\frac{{\overline{V}}_A\left(g\right)}{RT}-\frac{1}{P}\right)}\ }dP\]
Esta ecuación da la actividad de\(A\) en una solución líquida cuyo estado está especificado por la fracción molar en fase líquida\(y_A\). En particular, debe dar la actividad de\(A\) en la “solución” para la cual\(y_A=1\) y\(y_B=0\); por supuesto, esta “solución” es pura líquida\(A\). En equilibrio con líquido puro\(A\), la fase gaseosa contiene gas puro\(A\); por lo tanto, tenemos\(x_A=1\) y\(P=P^{\textrm{⦁}}_A\). El volumen molar parcial en fase gaseosa es el del gas puro,\({\overline{V}}^{\textrm{⦁}}_A\left(g\right)\). Además, esta “solución” es el estado estándar para la actividad de componente\(A\), para lo cual la actividad de\(A\) es unidad; es decir,
\({\tilde{a}}_A\left(P,y_A,y_B\right)={\tilde{a}}_A\left(P^{\textrm{⦁}}_A,1,0\right)=1\). Haciendo estas sustituciones en nuestra ecuación\({ \ln \left[{\tilde{a}}_A\left(P,y_A,y_B\right)\right]\ }\) y reordenando, encontramos
\[\frac{{\Delta }_fG^o\left(A,{HIG}^o\right)-{\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)}{RT}=-{ \ln \left[\frac{P^{\textrm{⦁}}_A}{P^o}\right]-\int^{P^{\textrm{⦁}}_A}_0{\left(\frac{{\overline{V}}^{\textrm{⦁}}_A\left(g\right)}{RT}-\frac{1}{P}\right)}\ }dP\]
Sustituyendo este resultado en nuestra ecuación general,\( \ln \left[ \tilde{a}_A\left(P,y_A,y_B\right)\right]\) encontramos una función completamente general para la actividad de componente\(A\).
\[ \ln \left[ \tilde{a}_A \left(P, y_A, y_B \right) \right] = \ln \left[ \frac{x_A P}{P^{\cdot}_A} \right] - \int_0^{P_A^{cdot}} \left( \frac{ \overline{V}_A^{\cdot} \left( g \right)}{RT} - \frac{1}{P} \right) dP + \int_)^P \left( \frac{ \overline{V}_A \left( g \right)}{RT} - \frac{1}{P} \right) dP \]
(cualquier solución;\(x_A\) es la fracción molar en el gas; el estado estándar para\(A\) en solución es el líquido puro a su presión de vapor de equilibrio)
En tal sistema, los papeles de soluto y disolvente son intercambiables. Intercambiar las etiquetas “\(A\)” y “B” da una ecuación para la actividad del componente\(B\).
Según lo justifiquen las circunstancias, se pueden aplicar varias aproximaciones a este resultado. Cuando el volumen molar parcial de\(A\) en el gas\({\overline{V}}_A\left(g\right)\),, no está disponible, se requiere alguna aproximación. Quizás la aproximación menos drástica es la introducida en la Sección 14.11. Equiparamos el volumen molar parcial desconocido con el volumen molar parcial del gas real puro a la misma presión del sistema. Ajuste\({\overline{V}}_A\left(g\right)={\overline{V}}^{\textrm{⦁}}_A\left(g\right)\), tenemos
\[{ \ln \left[{\tilde{a}}_A\left(P,y_A,y_B\right)\right]\ }={ \ln \left[\frac{x_AP}{P^{\textrm{⦁}}_A}\right]+\int^P_{P^{\textrm{⦁}}_A}{\left(\frac{{\overline{V}}^{\textrm{⦁}}_A\left(g\right)}{RT}-\frac{1}{P}\right)}\ }dP\]
Otras aproximaciones conducen a mayores simplificaciones. En las siguientes secciones, discutimos varios. Todos ellos asumen que los componentes se comportan idealmente en la fase gaseosa. En este caso, las integrales en nuestra ecuación general para\({ \ln \left[{\tilde{a}}_A\left(\ P,y_A,y_B\right)\right]\ }\) desaparecen. Entonces,
\[{ \ln \left[{\tilde{a}}_A\left(P,y_A,y_B\right)\right]\ }={ \ln \left[\frac{x_AP}{P^{\textrm{⦁}}_A}\right]\ }\]
(solución;\(x_A\) es la fracción molar en el gas ideal que está en equilibrio con la solución)
Nuestro resultado general da la actividad del componente\(A\) en solución utilizando la fracción molar de su propio vapor en el sistema de equilibrio. Cuando tenemos una función empírica,\(x_A=x_A\left(y_A\right)\), que relaciona la fracción molar en el gas con la de la solución, podemos hacer esta sustitución y expresar la actividad de\(A\) en la solución utilizando su concentración en la solución. En las siguientes secciones, desarrollamos algunos métodos básicos para encontrar\(x_A=x_A\left(y_A\right)\).


