16.2: Ley de Raoult y soluciones ideales
- Page ID
- 74147
Una solución ideal es una solución líquida homogénea que se encuentra en equilibrio con una solución de gas ideal en la que la presión de vapor de cada componente satisface la ley de Raoult \({}^{1}\). Dado que el gas es ideal, la presión parcial de\(A\) es\(P_A=x_AP\). La ley de Raoult afirma una relación entre las fracciones molares de fase gaseosa y solución\(A\), la presión de vapor del líquido puro y la presión del sistema:
\[P_A=x_AP=y_AP^{\textrm{⦁}}_A\]
(Ley de Raoult)
Para una mezcla binaria de\(A\) y\(B\) que satisfaga la ley de Raoult, tenemos también eso\(P_B=x_BP=y_BP^{\textrm{⦁}}_B\), y la presión total se vuelve\(P=P_A+P_B=y_AP^{\textrm{⦁}}_A+y_BP^{\textrm{⦁}}_B\). Las líneas esbozadas en la Figura 4 muestran cómo\(P_A\) y\(P\) varían con la composición de la fase de solución cuando la solución es ideal.\(P_B\)
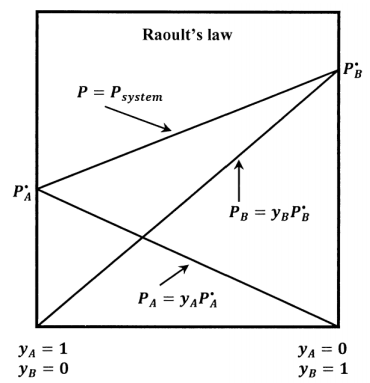
Cuando el estado estándar para\(A\) en solución se toma como líquido puro\(A\) a su presión de vapor de equilibrio, la sustitución de la ley de Raoult en los resultados de la Sección 16.1 da la actividad del componente\(A\) en una solución ideal como
\[{ \ln \left[{\tilde{a}}_A\left(P,y_A,y_B\right)\right]\ }={ \ln \left[\frac{x_AP}{P^{\textrm{⦁}}_A}\right]\ }={ \ln \left[\frac{y_AP^{\textrm{⦁}}_A}{P^{\textrm{⦁}}_A}\right]\ }={ \ln y_A\ }\]y
\[{\tilde{a}}_A\left(P,y_A,y_B\right)=y_A\]
(solución ideal, ley de Raoult)
En general, la actividad y el potencial químico de un componente dependen de la presión. Si la solución es ideal, vemos que la presión del sistema está fijada por\(P=y_AP^{\textrm{⦁}}_A+y_BP^{\textrm{⦁}}_B\), y las presiones de vapor de componentes puros dependen solo de la temperatura. Ya que para la solución binaria\(y_B=1-y_A\),, podemos escribir el potencial químico del componente\(A\) como
\[{\mu }_A\left(P,y_A,y_B\right)={\mu }_A\left(y_A\right)={\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)+RT{ \ln y_A\ }\](solución ideal)
También podemos usar las relaciones que desarrollamos antes para encontrar otra representación para\({\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)\). El potencial químico de\(A\) en la fase líquida es el mismo que en el gas. Utilizando el potencial químico para\(A\) en la fase gaseosa que encontramos en la Sección 16.1, tenemos
\[{\mu }_A\left(P,y_A,y_B\right)={\mu }_A\left(g,P,x_A,x_B\right)={\Delta }_fG^o\left(A,{HIG}^o\right)+RT{ \ln \left[\frac{x_AP}{P^o}\right]\ }={\Delta }_fG^o\left(A,{HIG}^o\right)+RT{ \ln \left[\frac{P^{\textrm{⦁}}_A}{P^o}\right]\ }+RT{ \ln y_A\ }\]y por lo tanto,\[{\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)={\Delta }_fG^o\left(A,{HIG}^o\right)+RT{ \ln \left[\frac{P^{\textrm{⦁}}_A}{P^o}\right]\ }\]
En la Sección 15.4, encontramos, para un gas ideal,
\[{\Delta }_fG^o\left(A,{HIG}^o\right)+RT{ \ln \left[\frac{P^{\textrm{⦁}}_A}{P^o}\right]\ }={\Delta }_fG^o\left(A,\ell \right)+\int^{P^{\textrm{⦁}}_A}_{P^o}{{\overline{V}}^{\textrm{⦁}}_A\left(\ell \right)}dP\]
de manera que el potencial químico del líquido puro a su presión de vapor también está dado por\[{\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)={\Delta }_fG^o\left(A,\ell \right)+\int^{P^{\textrm{⦁}}_A}_{P^o}{{\overline{V}}^{\textrm{⦁}}_A\left(\ell \right)}dP\]
La integral es la diferencia entre la energía libre de Gibbs del líquido puro a su presión de vapor y la del líquido puro a\(P^o=1\ \mathrm{bar}\). Obsérvese que podemos obtener el mismo resultado mucho más simplemente integrando\({\left(dG^{\textrm{⦁}}_A\right)}_T={\overline{V}}^{\textrm{⦁}}_AdP\) entre los mismos dos estados. En la Sección 15.3, vemos que el valor de la integral suele ser insignificante. A una buena aproximación, tenemos
\[{\widetilde{\mu }}^o_A\left(\ell ,P^{\textrm{⦁}}_A\right)\approx {\Delta }_fG^o\left(A,\ell \right)\]
(solución ideal)


