17.2: Celdas Electroquímicas
- Page ID
- 74396
Podemos extender la idea de llevar a cabo los pasos de pérdida de electrones y ganancia de electrones en diferentes ubicaciones físicas. Supongamos que las únicas especies acuosas en contacto con el metal plateado son los iones plata y los iones nitrato; el metal plateado también está en contacto con una longitud de alambre de cobre, cuyo otro extremo se sumerge en un depósito separado que contiene una solución acuosa de nitrato de sodio. Esta disposición se esboza en la Figura 1. Cuando creamos este arreglo, no pasa nada. No vemos ningún cambio visible en el metal plateado, y el agua que entra en contacto con el alambre de cobre nunca se vuelve azul. Por un lado, este resultado no nos sorprende. Estamos acostumbrados a la idea de que los reactivos deben poder contactar entre sí para que se produzca la reacción.
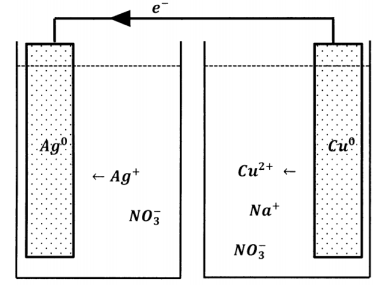
Por otro lado, el experimento original realmente muestra que los iones de plata pueden aceptar electrones en una ubicación mientras que los átomos de cobre los abandonan en otra, siempre y cuando proporcionemos un puente metálico sobre el que los electrones puedan moverse entre las dos ubicaciones. ¿Por qué esto no debería seguir ocurriendo en el nuevo arreglo experimental? De hecho, lo hace. Es solo que la reacción se produce en muy poca medida antes de detenerse por completo. La razón es fácil de apreciar. Después de que se reduce un número muy pequeño de iones de plata, la solución de nitrato de plata contiene más iones nitrato que iones de plata; la solución en su conjunto tiene una carga negativa. En el otro reservorio se disuelve un pequeño número de iones cúpricos, pero no hay incremento en el número de contraiones, por lo que esta solución adquiere una carga positiva. Estas cargas netas polarizan el metal que las conecta; el metal tiene un exceso de carga positiva en el extremo de la solución de cobre y un exceso de carga negativa en el extremo de la solución de plata. Esta polarización se opone al movimiento de un electrón cargado negativamente desde el extremo de la solución de cobre hacia el extremo de la solución de plata. Cuando la polarización se vuelve suficientemente grande, el flujo de electrones cesa y no puede ocurrir ninguna reacción adicional.
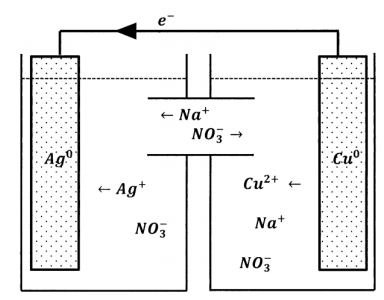
Mediante este análisis, los aniones que la solución cúprica necesita para lograr la electroneutralidad están presentes en la solución de iones de plata. La reacción se detiene porque los aniones no tienen forma de pasar de una solución a otra. Evidentemente, la forma de hacer que la reacción proceda es modificar el experimento de dos depósitos para que los iones nitrato puedan pasar del depósito de solución de plata al depósito de solución de cobre. Alternativamente, podríamos introducir una modificación que permita que los iones de cobre se muevan en la dirección opuesta o una que permita ambos tipos de movimiento. Podemos lograr esto último conectando las dos soluciones con un tubo que contiene solución de nitrato de sodio, como se esquematiza en la Figura 2. Ahora, los iones nitrato pueden moverse entre los reservorios y mantener la electroneutralidad en ambos. Sin embargo, los iones de plata también pueden moverse entre los reservorios. Cuando hacemos este experimento, observamos que los electrones sí fluyen a través del alambre, lo que indica que la reducción de iones de plata y la oxidación de átomos de cobre están ocurriendo en los sitios separados. Sin embargo, después de poco tiempo, las soluciones se mezclan; los iones de plata migran a través del medio acuoso y reaccionan directamente con el metal cobre. Debido a que la mezcla es poco controlable, la reproducibilidad de este experimento es pobre.
Evidentemente, necesitamos una forma de permitir el intercambio de iones entre los dos reservorios que no permita la transferencia al por mayor de especies reactivas. Un dispositivo que logra esto se llama puente de sal. El requisito que enfrentamos es que los iones deben poder migrar de reservorio a reservorio para mantener la electroneutralidad. Sin embargo, no queremos que los iones que participan en las reacciones de los electrodos migren. Un puente de sal es simplemente una solución salina que utilizamos para conectar los dos reservorios. Para evitar la introducción de iones no deseados en las soluciones de reservorio, preparamos la solución de puente salino utilizando una sal cuyos iones no se oxidan o reducen fácilmente. A menudo se utilizan sales de metales alcalinos con aniones nitrato, perclorato o haluro. Para evitar mezclar las soluciones del depósito con la solución del puente de sal, taponamos cada extremo del puente de sal con un material poroso que permite la difusión de iones pero inhibe el movimiento masivo de la solución dentro o fuera del puente. La inhibición del movimiento a granel se puede hacer mucho más efectiva llenando el puente con un gel, de modo que la solución no pueda sufrir movimiento masivo en ninguna parte del puente.
Con un puente de sal en su lugar, los iones inertes pueden moverse de un reservorio a otro para mantener la electroneutralidad. En estas condiciones, vemos una corriente eléctrica a través del circuito externo y una difusión compensadora de iones a través del puente salino. El puente de sal completa el circuito. El transporte de electrones de un electrodo al otro lleva carga en una dirección; el movimiento de especies iónicas a través del puente salino lleva carga negativa a través de la solución en la dirección opuesta. Este movimiento iónico compensador tiene aniones que se mueven opuestos al movimiento de los electrones y cationes moviéndose en la misma dirección que los electrones.
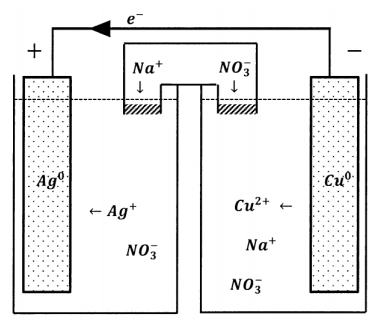
Acabamos de describir un tipo de celda electroquímica. Como se esquematiza en la Figura 3, tiene cuatro características principales: dos reservorios dentro de los cuales pueden ocurrir reacciones, un cable a través del cual los electrones pueden pasar de un reservorio al otro, y un puente salino por el que pueden pasar especies iónicas. Se pueden construir muchas celdas electroquímicas similares. Los reservorios pueden contener una amplia variedad de reactivos. Debido a que cada depósito debe ser capaz de intercambiar electrones con el cable de conexión, cada uno debe contener un sólido eléctricamente conductor que sirva como terminal y colector de corriente, y a menudo participa en el cambio químico como reactivo o como catalizador. La combinación de reactivos y colector de corriente se llama media celda. El colector de corriente en sí se llama electrodo, aunque este término suele aplicarse también a toda la media celda. En este caso, el cable es el circuito externo. En aplicaciones de interés químico, el circuito externo contiene típicamente dispositivos para medir las propiedades de la celda electroquímica como elemento de circuito.
Si vemos esta celda electroquímica como un dispositivo para producir una corriente eléctrica, vemos que tiene una serie de limitaciones prácticas. Dos de los más importantes se relacionan con el desempeño del puente de sal. Siempre que los electrones se mueven a través del circuito externo, el puente salino debe aceptar un número de iones compensador de carga de un reservorio y liberar la misma cantidad de carga iónica al otro reservorio. Construimos el puente salino para que los iones puedan entrar y salir de él solo por difusión. En consecuencia, la velocidad a la que los iones pueden difundirse a través del puente de sal limita la velocidad a la que los electrones pueden fluir a través del circuito externo. Dado que la difusión es un proceso lento sobre las dimensiones macroscópicas del puente, la celda solo puede pasar una pequeña corriente. Desde una perspectiva eléctrica, la lenta difusión de iones a través del puente salino hace que un excedente de especies cargadas positivamente se desarrolle en un extremo del puente salino y un excedente de especies cargadas negativamente se desarrolle en el otro. Este desequilibrio de carga significa que existe un gradiente de potencial a través del puente de sal, cuyo efecto es oponerse al flujo de corriente adicional.
La segunda limitación de la celda atribuible a las propiedades del puente salino es que la cantidad de corriente que puede producir la celda antes de que sus características de rendimiento cambien drásticamente está limitada por la cantidad de sal inerte en el puente. Después de que una carga relativamente pequeña pasa a través de la célula, la migración de especies reactivas de un reservorio a otro se vuelve significativa. Las fuentes de energía electroquímica efectivas deben usar otros métodos para separar reactivos y productos mientras permiten el transporte de iones entre medias celdas.
A pesar de estas limitaciones, tales celdas electroquímicas son herramientas muy efectivas para el estudio de la termodinámica de las reacciones electroquímicas. La interacción principal entre electroquímica y termodinámica gira en torno a la relación entre el cambio de energía libre para la reacción y las propiedades de la celda electroquímica vista como un elemento de circuito. En la Sección 17.14, vemos que el cambio de energía libre de Gibbs para la reacción química es proporcional al potencial eléctrico que se desarrolla a través de los terminales de la celda electroquímica correspondiente.
En experimentos, encontramos que la diferencia de potencial eléctrico a través de una celda depende de la cantidad de corriente que se está extrayendo de la celda. Debido a que el movimiento de iones y otras sustancias dentro de la celda es lento en comparación con la velocidad a la que un cable puede transferir electrones de un terminal a otro, las diferencias de potencial que se desarrollan dentro de una celda operativa disminuyen el potencial eléctrico a través de los terminales. Solo cuando la corriente que se extrae de la celda es cero, el potencial eléctrico corresponde precisamente al cambio de energía libre de Gibbs de la reacción química que ocurre en la celda. Esto no debería sorprendernos. La medición experimental de cualquier función termodinámica dependiente de entropía debe realizarse en un sistema que está experimentando un cambio reversible. Un cambio reversible en una celda electroquímica es un cambio en el que el flujo de corriente es cero.
Medir el potencial eléctrico a corriente cero es experimentalmente sencillo, al menos en principio. Conectamos la celda a algún dispositivo de referencia que proporciona un potencial eléctrico conocido y variable. La conexión se realiza de tal manera que el potencial eléctrico del dispositivo de referencia se opone al potencial de la celda electroquímica; es decir, conectamos el terminal positivo del dispositivo de referencia al terminal positivo de la celda, y el terminal negativo del dispositivo al terminal negativo del celular. (Ver Sección 17.7.) Luego variamos el potencial del dispositivo de referencia hasta que se detiene el flujo de corriente en el circuito. Cuando esto ocurre, la caída de potencial que suministra el dispositivo de referencia debe ser exactamente igual a la caída de potencial a través de la celda electroquímica, que es el dato que queremos.
En la práctica, el dispositivo de referencia es otra celda electroquímica “estándar”, cuya caída de potencial se define para tener un valor particular en condiciones especificadas. La electrónica moderna permite hacer las mediciones reales con gran sofisticación. Las mediciones necesarias también se pueden hacer con un equipo muy básico. Los principios siguen siendo los mismos. En el experimento básico, se utiliza una resistencia variable para ajustar la caída de potencial a través de la celda estándar hasta que coincida exactamente con la de la celda que se está estudiando. Cuando se alcanza este potencial, cesa el flujo de corriente. El flujo de corriente es monitoreado usando un galvanómetro sensible. No es necesario medir realmente la corriente. Dado que estamos interesados en localizar la caída potencial a la que el flujo de corriente es cero, basta con encontrar la caída potencial a la que el galvanómetro no detecta corriente. La precisión de la medición del potencial depende de la estabilidad del potencial de celda estándar, la precisión de la resistencia variable y la sensibilidad del galvanómetro.


