17.7: La dirección del flujo de electrones y sus implicaciones
- Page ID
- 74354
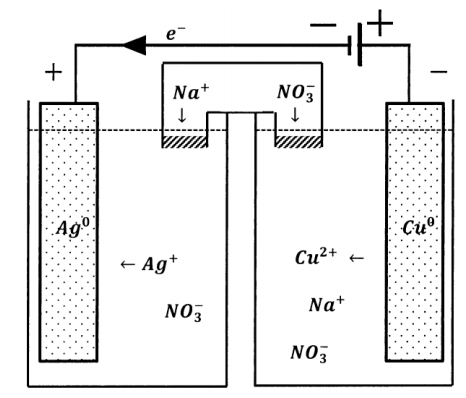
Podemos incorporar otra fuente potencial en el circuito externo de una celda electroquímica. Si lo hacemos de tal manera que los dos potenciales eléctricos se incrementen entre sí, como se esquematiza en la Figura 4, la caída de potencial alrededor del nuevo circuito externo es la suma de las caídas de potencial de las dos fuentes tomadas independientemente. La dirección del flujo de electrones no cambia. Un electrón en cualquier parte del circuito externo es propulsado en la misma dirección por cualquiera de las fuentes potenciales. La diferencia de potencial efectiva en el circuito compuesto es la suma de los potenciales que exhiben las fuentes cuando cada una actúa sola.
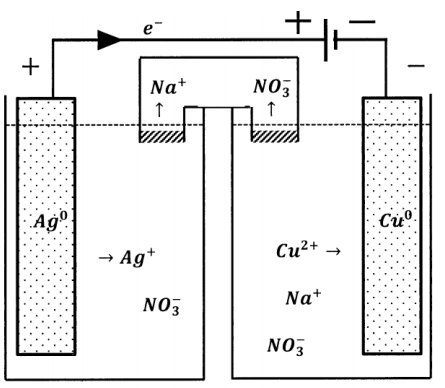
Alternativamente, podemos conectar las dos fuentes potenciales para que se opongan entre sí, como se esquematiza en la Figura 5. Ahora un electrón en el circuito externo es empujado en una dirección por una de las fuentes potenciales y en la dirección opuesta por la otra fuente potencial. La diferencia de potencial efectiva en el circuito compuesto es la diferencia entre los potenciales que exhiben las fuentes cuando cada una actúa sola. En el circuito compuesto, la dirección del flujo de electrones está determinada por la fuente de potencial cuya diferencia de potencial es mayor.
Esto tiene un efecto dramático en la dirección de la reacción que ocurre en la célula más débil. En la celda compuesta, la dirección del flujo de electrones a través de la celda más débil es opuesta a la dirección del flujo de electrones cuando la celda más débil está operando como una celda galvánica. Dado que la dirección del flujo de electrones en el circuito externo determina las direcciones en las que ocurren las medias reacciones, la reacción química que ocurre en la celda debe ocurrir también en la dirección opuesta. Cuando la dirección del flujo de corriente a través de una celda se determina por la conexión a una mayor diferencia de potencial de esta manera, la celda se denomina celda electrolítica. La reducción ocurre en el terminal negativo de una celda electrolítica. En una celda electrolítica, el cátodo es el electrodo eléctricamente negativo. La dirección del flujo de corriente en cualquier celda puede invertirse mediante la aplicación de un contrapotencial suficientemente grande.
Cuando una celda opera como fuente de corriente (es decir, como celda galvánica), la reacción celular es un proceso espontáneo. Dado que, a medida que avanza la reacción celular, los electrones se mueven a través de una diferencia de potencial en el circuito externo, la reacción libera energía en los alrededores de la célula. Si el circuito externo es simplemente una resistencia, como cuando los terminales están cortocircuitados, la energía se libera como calor. Dejar\(q\) ser el calor liberado y dejar que\(Q\) sea la cantidad de carga que pasa a través del circuito externo en un intervalo de tiempo\(\Delta t\). La velocidad de liberación de calor viene dada por
\[\frac{q}{\Delta t}=\frac{\Delta E}{\Delta t}=\frac{Q\mathcal{E}}{\Delta t}\]
La corriente eléctrica es\(I={Q}/{\Delta t}\). Si la resistencia sigue la ley de Ohm,\(\mathcal{E}=IR\), donde\(R\) está la magnitud de la resistencia, la tasa de liberación de calor se vuelve
\[\frac{q}{\Delta t}=I^2R\]
A medida que avanza la reacción y la energía se disipa en el circuito externo, la capacidad de la célula para suministrar más energía disminuye continuamente. La energía entregada al entorno a través del circuito externo viene a expensas de la energía interna de la célula y corresponde al agotamiento de los reactivos celulares.
Cuando la reacción química que ocurre dentro de una celda es impulsada por la aplicación de una diferencia de potencial suministrada externamente, ocurre lo contrario. En la celda conducida (electrolítica), la dirección de la reacción celular es opuesta a la dirección de la reacción espontánea que ocurre cuando la celda opera galvánicamente. El proceso electrolítico produce los reactivos químicos que se consumen en la reacción celular espontánea. El circuito externo entrega energía a la celda electrolítica, aumentando su contenido de reactivos de dirección espontánea y aumentando así su capacidad de trabajo.
En resumen, la diferencia esencial entre las celdas electrolíticas y galvánicas radica en el factor que determina la dirección del flujo de corriente y, correspondientemente, la dirección en la que se produce la reacción celular. En una celda galvánica, se produce una reacción química espontánea y esta reacción determina la dirección del flujo de corriente y los signos de los potenciales de los electrodos. En una celda electrolítica, el signo de los potenciales de electrodo está determinado por una fuente de potencial aplicada, que determina la dirección del flujo de corriente; la reacción de la celda avanza en la dirección no espontánea.


