5.2: Variaciones horizontales
- Page ID
- 69418
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Los valores experimentales de los radios atómicos y los potenciales de ionización primero y segundo de los elementos (etiquetados como I 1 y I 2 respectivamente) en la tercera fila de la tabla periódica se listan en la Tabla 5-1. Un estudio de estos valores indicará las tendencias básicas observadas a medida que el número de electrones se incrementa uno a la vez hasta que todos los orbitales con un valor dado de n estén completamente ocupados.
| Elemento | Na | Mg | Al | Si | P | S | Cl | Ar |
|---|---|---|---|---|---|---|---|---|
| Radio (Å) | 1.86 | 1.60 | 1.48 | 1.17 | 1.0 | 1.06 | 0.97 | |
| I 1 (ev) | 5.14 | 7.64 | 5.98 | 8.15 | 11.0 | 10.4 | 13.0 | 15.8 |
| I 2 (ev) | 47.3 | 15.0 | 18.8 | 16.3 | 19.7 | 23.4 | 23.8 | 27.6 |
*Los valores para I 1 e I 2 son tomados de C. E. Moore, Niveles de Energía Atómica, Vol. 1, N.B.S. Circular 467, Washington, D.C. (1949). I 2 es la energía requerida para eliminar un electrón del ion de carga única, es decir, la energía requerida para ionizar un segundo electrón.
Radios atómicos
El diámetro de un átomo es difícil de definir precisamente ya que la distribución de la densidad se reduce a grandes distancias. Sin embargo, existe un límite en cuanto a cuán cerca se pueden juntar dos átomos en un material sólido. Tomaremos la mitad de la distancia entre los núcleos de dos átomos en un sólido elemental como una medida aproximada del radio atómico. Cualquier método consistente de definir el radio conduce a la misma tendencia que vemos en la Tabla 5-1. El tamaño del átomo en general disminuye a medida que aumenta el número de electrones en la capa cuántica. Esta observación, que a primera vista puede parecer sorprendente, encuentra una explicación lista a través del concepto de carga nuclear efectiva.
El campo eléctrico y por lo tanto la fuerza de atracción ejercida por el núcleo sobre un electrón en la capa cuántica externa se reduce debido al efecto de cribado de los otros electrones que están presentes en el átomo. Un electrón externo no penetra en gran medida la distribución de densidad estrechamente unida de los electrones de la capa interna. En consecuencia, cada electrón interno (un electrón con un valor n menor que el valor n del electrón en cuestión) reduce el valor de la carga nuclear experimentada por el electrón externo en casi una unidad. Los electrones externos restantes por otro lado están, en promedio, todos a la misma distancia del núcleo que el electrón bajo consideración. En consecuencia, cada electrón externo proyecta considerablemente menos de una carga nuclear de los otros electrones externos. Por lo tanto, cuanto mayor sea la relación de electrones de la capa externa a la capa interna, mayor será la “carga nuclear efectiva” que experimenta un electrón en la capa externa.
Todos los elementos de una fila dada de la tabla periódica poseen el mismo número de electrones de capa interna. Por ejemplo, los elementos de la tercera fila tienen la configuración de concha interior de 1 s 2 2 s 2 2 p 6. A medida que avanzamos a través de la tabla periódica de izquierda a derecha la carga nuclear aumenta, y cada electrón agregado se coloca en la capa exterior hasta que se alcanza un total de ocho y la capa cuántica está llena. El número de electrones de la capa externa aumenta a lo largo de un período determinado, pero el número de electrones de la capa interna permanece fijo. Así, la carga nuclear efectiva aumenta de un valor mínimo para el sodio, donde la relación de electrones de la capa externa a la capa interna es de 1:10, a un valor máximo para el argón donde la misma relación es 8:10. El radio atómico sufre una disminución gradual ya que los electrones externos se unen más estrechamente a medida que aumenta la carga nuclear efectiva.
Estas características de las distribuciones de densidad atómica son claramente evidentes en una gráfica de la función de distribución radial, Q (r). Esta función, se recordará, da el número de cargas electrónicas dentro de un delgado caparazón de espacio que se encuentra entre dos esferas concéntricas, una de radio r y la otra con un radio sólo ligeramente mayor. Las funciones de distribución radial para los átomos pueden determinarse experimentalmente mediante técnicas de difracción de rayos X o electrones.
Las gráficas de Q (r) versus r para sodio y argón (Fig. 5-1), el primer y último miembro de la tercera fila de la tabla periódica, revelan claramente la persistencia de una “estructura de concha” en los muchos átomos de electrones.
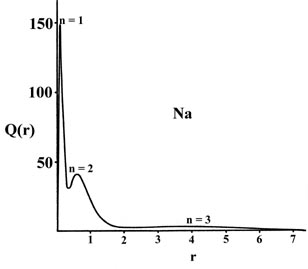
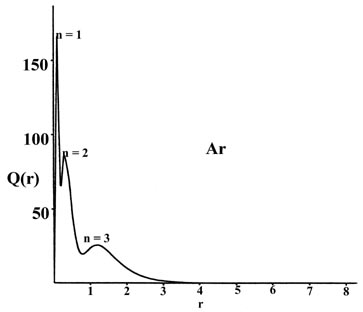
Fig. 5-1. La distribución radial funciona Q (r) para los átomos de Na y Ar.
Hay tres picos en la distribución de densidad correspondientes a la presencia de tres conchas cuánticas principales en el modelo orbital de la estructura electrónica de sodio y argón. El pico más cercano al núcleo puede identificarse con la densidad de carga en el orbital de 1 s, el pico medio con el de los orbitales de 2 s y 2 p y el pico externo con la densidad de carga en el orbital de 3 s en sodio y en los 3 s y 3 p orbitales en argón. Los máximos en Q (r) ocurren a valores menores de r para argón que para sodio como se esperaba sobre la base de una carga nuclear efectiva mayor para argón que para sodio. La mayor parte de la densidad de carga de 1 s se encuentra dentro de una capa muy delgada cerca del núcleo en ambos casos ya que la densidad de la cubierta interna experimenta el campo de la carga nuclear completa, Z Na = 11 y Z Ar = 18. La densidad de carga en los orbitales n = 2 está confinada a una concha que es más estrecha y cercana al núcleo en argón que en sodio. Los electrones en esta segunda capa experimentan una carga nuclear de aproximadamente dieciséis en argón pero de solo nueve en sodio.
El efecto más dramático de la diferencia en las cargas nucleares efectivas de argón y sodio se evidencia por la aparición de la densidad de electrones en la capa de valencia. En el sodio esta capa es amplia y difusa ya que hay diez electrones internos que blindan once cargas nucleares. En el argón donde hay diez electrones internos para blindar dieciocho cargas nucleares, la capa de valencia está más contraída y alcanza su punto máximo aproximadamente a un tercio de la distancia correspondiente en sodio. La densidad de la concha de valencia está claramente más unida en argón que en sodio.
La Figura 5-2 muestra el efecto de un incremento en la carga nuclear sobre las densidades orbitales atómicas individuales para elementos de la misma fila de la tabla periódica, en este caso sodio y cloro. La distribución de densidad total para el átomo se obtiene sumando las densidades orbitales individuales. La suma de solo las densidades de 1 s, 2 s y tres de 2 p produce las densidades esféricas de concha interna indicadas en el diagrama como “densidades de núcleo”. Es la densidad del núcleo la que protege la carga nuclear de los electrones de valencia. El contorno de densidad exterior indicado para la capa interna o densidades del núcleo define un volumen en el espacio que contiene más del 99% de la carga electrónica de los electrones de la cubierta interna. Así, la carga nuclear efectiva experimentada por la densidad de valencia más allá de los radios indicados de las densidades centrales es Z Na - 10 = 1 para el sodio y Z Cl - 10 = 7 para el cloro. Observe que el radio de la densidad del núcleo es menor para el cloro que para el sodio y así la fuerza de atracción ejercida sobre los electrones de valencia por cada una de las cargas nucleares no tamizadas será mayor en cloro que en sodio.
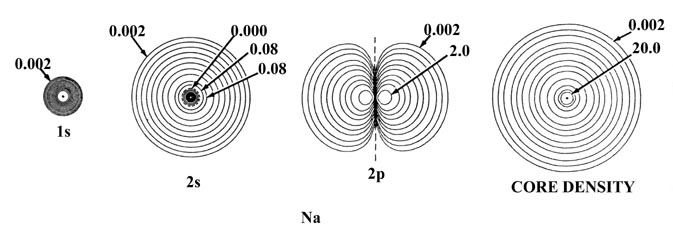
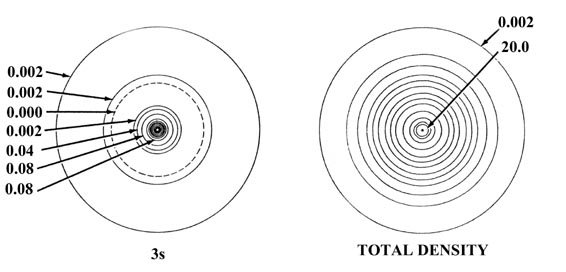
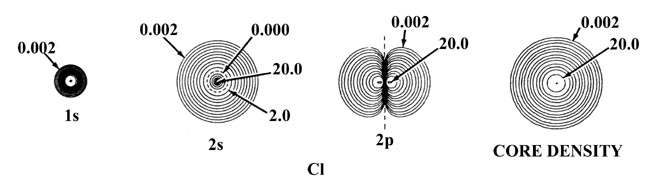
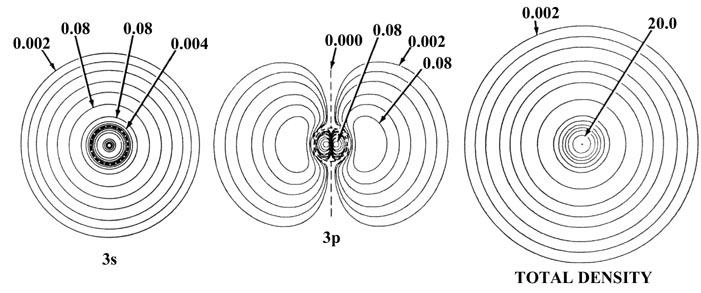
Fig. 5-2. Densidades de carga orbital atómica para los átomos de Na y Cl. Solo se muestra un miembro de un conjunto de orbitales 2p o 3p. Los nodos se indican mediante líneas discontinuas. El nodo interno de la órbita 3s está demasiado cerca del núcleo para ser indicado en el diagrama. Cuando dos contornos vecinos tienen el mismo valor, como por ejemplo los dos contornos más externos en la densidad 3s de Na, la densidad de carga pasa a través de algún valor máximo entre los dos contornos, disminuyendo a cero en la línea nodal. En términos del contorno más externo mostrado en las gráficas de densidad total (0.002 au) el átomo de Cl parece ser mayor que el átomo de Na. La densidad de carga externa de Na es, sin embargo, muy difusa (como lo muestra la gráfica de Q (r) en la Fig. 5-1) y en términos de contornos de densidad de valor inferior a 0.002 au el átomo de Na es de hecho mayor que el átomo de Cl. Los valores de contornos no indicados en la figura se pueden obtener haciendo referencia a la Tabla de Valores de Contorno.
Hay una excepción a la tendencia de una disminución del diámetro a lo largo de una fila dada en que el fósforo tiene un radio atómico ligeramente menor que el del azufre que le sigue en la tabla. La configuración de los electrones externos en fósforo es 3 s 2 3 p 3 (). Cada uno de los orbitales p contiene un solo electrón y según la regla de Hund todos tendrán el mismo número cuántico de espín. Los electrones con espines idénticos tienen energías de repulsión electrón-electrón más pequeñas que los electrones con espines emparejados, por razones que hemos mencionado anteriormente. Por lo tanto, cuanto mayor sea el número de espines paralelos en un átomo, menor será la energía promedio de repulsión entre los electrones. Tres es el número máximo de giros desapareados posibles en cualquiera de los períodos cortos, ya que esto corresponde a un conjunto medio lleno de p orbitales. El efecto estabilizador de la disminución de la energía de repulsión entre los electrones es comparable al efecto obtenido al aumentar la carga nuclear efectiva en aproximadamente uno. Esto se puede ver comparando fósforo con azufre. El azufre tiene una carga nuclear incrementada pero el electrón agregado debe ser emparejado con uno de los electrones en los orbitales p. El número de electrones desapareados con espines paralelos se reduce así a dos, se incrementa la energía promedio de repulsión entre los electrones y el átomo de azufre es ligeramente mayor que el átomo de fósforo.
La disminución de energía que se obtiene al maximizar el número de espines paralelos no es suficiente para cambiar la configuración externa más estable que se encuentra realmente para el silicio, 3 s 2 (¯) 3 p 2 ( ), a aquella en la que los cuatro electrones externos tienen espines paralelos, 3 s 1 () 3 p 3 (). Esta última configuración sólo podría obtenerse promoviendo un electrón de un orbital de 3 s a un orbital de 3 p. El orbital de 3 s es más estable que un orbital de 3 p debido al efecto de penetración, y el aumento de energía causado por la promoción de un electrón de 3 s a un orbital de 3 p no se compensaría por la disminución de energía obtenida al maximizar el número de giros paralelos. Es interesante señalar, sin embargo, que lo contrario de esto es cierto para algunos de los elementos de la serie de transición. En estos elementos los orbitales 4 s y 3 d (o en general los ns y (n - l) d) son los orbitales exteriores. La diferencia de energía entre un orbital ns y un (n - 1) d es mucho menor que entre un orbital ns y un np. Así, el efecto de maximizar el número de giros paralelos puede ser primordial en estos casos. La estructura electrónica externa del vanadio es de 4 s 2 3 d 3. (Recordemos que hay cinco orbitales d y de ahí la configuración d 5 representará cinco electrones con espines paralelos). Esperaríamos que la configuración electrónica exterior del siguiente elemento, cromo, sea 4 s 2 3 d 4 con cuatro giros paralelos. En cambio, la configuración es en realidad 4 s 1 3 d 5 resultando en un total de seis espines paralelos y una reducción en la energía de repulsión entre los electrones.
Los potenciales de ionización
La referencia al Cuadro 5-1 indica que en general la cantidad de energía requerida para eliminar uno de los electrones externos aumenta a medida que aumenta la carga nuclear efectiva. El aumento en I 1 de aproximadamente 5 ev para sodio a aproximadamente 16 ev para argón ilustra dramáticamente el aumento en la fuerza que el núcleo ejerce sobre los electrones externos como la carga nuclear y el número de electrones externos es aumentado. El efecto del conjunto medio lleno de orbitales p es nuevamente evidente ya que I 1 es ligeramente mayor para el fósforo que para el azufre. Existe una aparente discrepancia en el valor para I 1 observado para el magnesio. La configuración electrónica externa del magnesio es de 3 s 2 y para el aluminio es de 3 s 2 3 p 1. El valor de 7.64 ev observado para el magnesio es la energía requerida para eliminar un electrón de 3 s, mientras que el valor cotizado para el aluminio es la energía requerida para eliminar un electrón de 3 p. Un orbital s es más estable que un orbital p debido a su mayor penetración en el núcleo interno de densidad electrónica. Así, el efecto de penetración anula el incremento de la carga nuclear efectiva. Podemos probar la validez de esta explicación comparando las energías requeridas para eliminar un segundo electrón (I2) de los átomos de magnesio y aluminio. Las configuraciones electrónicas externas de los iones magnesio y aluminio de carga única son 3 s 1 y 3 s 2. Así, una comparación de los segundos potenciales de ionización (I 2) estará libre de la complicación por el efecto de penetración porque estaremos comparando la cantidad de energía requerida para eliminar un electrón s en cada caso Los valores en la Tabla 5-1 indican que la eliminación de un electrón s requiere más energía en el aluminio que en el magnesio, resultado que es consistente con la mayor carga nuclear efectiva para el aluminio que para el magnesio. ¿Qué explicación se puede dar a que el segundo potencial de ionización del azufre sea casi igual al del cloro?
Vale la pena señalar el gran valor del segundo potencial de ionización observado para el sodio. El ion sodio tiene la configuración electrónica 1 s 2 2 s 2 2 p 6, es decir, no quedan electrones externos. El segundo potencial de ionización para el sodio es, por lo tanto, una medida de la cantidad de energía requerida para eliminar uno de lo que inicialmente fueron electrones de capa interna en el átomo neutro. La carga nuclear efectiva experimentada por un electrón de 2 p en el ion sodio será muy grande de hecho, debido a que el número de electrones de la capa interna para un electrón n = 2 es solo de dos. Es decir, sólo los dos electrones en el orbital de 1 s ejercen un gran efecto de cribado. Por lo tanto, acoplado al hecho de que el ion lleva una carga neta positiva, está el hecho de que la relación de electrones de la capa externa a interna es 8:2, lo que es aún más favorable que la obtenida para el argón. (Recordemos que en el átomo de sodio neutro la relación es 1:10.) El valor de I 2, para el sodio enfatiza nuevamente la estabilidad electrónica de una carcasa cerrada, una estabilidad que es un reflejo directo del gran valor de la carga nuclear efectiva operativa en tales casos.

