8.2: Momento Angular en Moléculas Diatómicas
- Page ID
- 69437
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Las simetrías espaciales de los orbitales atómicos y el número de cada tipo de simetría están determinados por el momento angular del electrón. De hecho, los orbitales están etiquetados por los números cuánticos de momento angular, l y m, que junto con el número cuántico principal n, especifican completamente el orbital. El momento angular juega un papel similar en la determinación de las simetrías y el número de orbitales de cada especie de simetría en el caso molecular.
En un átomo todo el momento angular es de origen electrónico. En el caso molecular, la molécula en su conjunto gira en el espacio y los núcleos contribuyen al momento angular total del sistema. Los núcleos y los electrones de una molécula diatómica pueden rotar alrededor de ambos ejes que son perpendiculares al eje del enlace (Fig. 8-1).
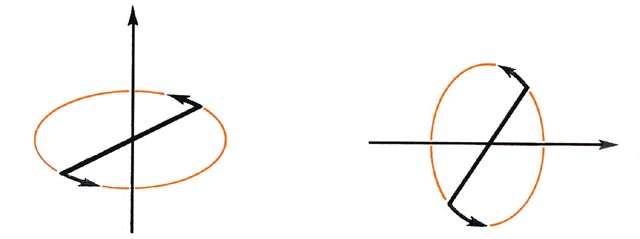
Fig. 8-1. Dos ejes rotacionales para una molécula diatómica.
En un análogo clásico los electrones y los núcleos intercambian momento angular durante estas rotaciones y el momento angular de los electrones no se conserva por separado. Así, no se cuantifica la magnitud del momento angular electrónico total en una molécula diatómica, a diferencia del caso atómico. En cambio, se cuantifica la magnitud del momento angular total, núcleos y electrones. Solo los electrones, sin embargo, pueden rotar alrededor del eje internuclear y esta componente del momento angular es de origen completamente electrónico. Mientras la molécula quede inalterada, este componente del momento angular permanece fijo en valor y su magnitud, por lo tanto, se cuantifica.
El vector de momento angular para la rotación alrededor del enlace se ubicará a lo largo del eje de unión. Este vector representa la componente del vector de momento angular total a lo largo del eje internuclear. Como en el caso atómico, la mecánica cuántica restringe los valores de la componente del vector de momento angular total a lo largo de un eje dado a múltiplos integrales de (h /2 p). El número cuántico en este caso se denota con la letra griega l (lambda). Es análogo al número cuántico m en el caso atómico. Los valores posibles para l son
\[ \lambda = 0,1,2,3,...\]
Dado que la rotación puede ocurrir en sentido horario o antihorario alrededor del eje, el componente de vector de momento angular puede estar apuntando en cualquier dirección a lo largo del enlace (Fig. 8-2).
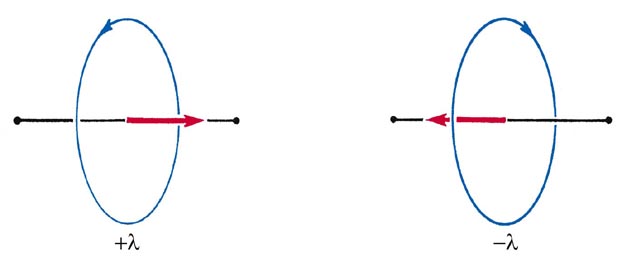
Fig. 8-2. Las dos direcciones para el vector de momento angular orbital l para la rotación de un electrón alrededor del eje internuclear de una molécula diatómica.
Correspondientemente, los valores permitidos del momento angular alrededor del eje internuclear son 0, ±1 (h /2 p), ±2 (h /2 p), etc., o en general, ± l (h /2 p). Así, cuando l es diferente de cero, cada nivel de energía es doblemente degenerado correspondiente a las dos direcciones posibles para el componente l a lo largo del eje de unión.
Los orbitales moleculares se etiquetan de acuerdo con los valores del número cuántico l. Cuando l = 0, se les llama orbitales s; cuando l = 1, p orbitales; cuando l = 2, d orbitales, etc. Esto es análogo al etiquetado de los orbitales atómicos como s, p, d,.,., como se determina por su valor l.
Sabemos menos sobre el momento angular de un electrón en una molécula diatómica que en un átomo. En el caso atómico es posible determinar la magnitud del momento angular total, dado por el número cuántico l, y la magnitud de uno de sus componentes, dada por el número cuántico m. En una molécula lineal nuestro conocimiento es más restringido y estamos limitados a un solo número cuántico l, que determina solo la componente del momento angular alrededor del eje del enlace.

