3.4: Calorimetría
- Page ID
- 72675
Como químicos, nos preocupan los cambios y reacciones químicas. La termodinámica de las reacciones químicas puede ser muy importante en términos de controlar la producción de los productos deseados y prevenir riesgos de seguridad como explosiones. Como tal, medir y comprender la termoquímica de las reacciones químicas no solo es útil, ¡sino esencial!
Calorimetría
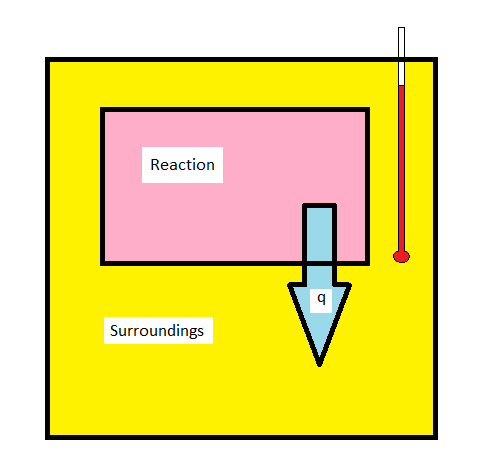
Las técnicas de calorimetría se pueden utilizar para medir q para una reacción química directamente. El cambio de entalpía para una reacción química es de gran interés para los químicos. Una reacción exotérmica liberará calor (\(q_{reaction} < 0\),\(q_{surroundings} > 0\)) haciendo que la temperatura del entorno aumente. Por el contrario, una reacción endotérmica (\(q_{reaction} > 0\),\(q_{surroundings} < 0\)) extraerá calor del entorno, haciendo que la temperatura del entorno baje. Medir el cambio de temperatura en el entorno permite determinar cuánto calor se liberó o absorbió en la reacción.
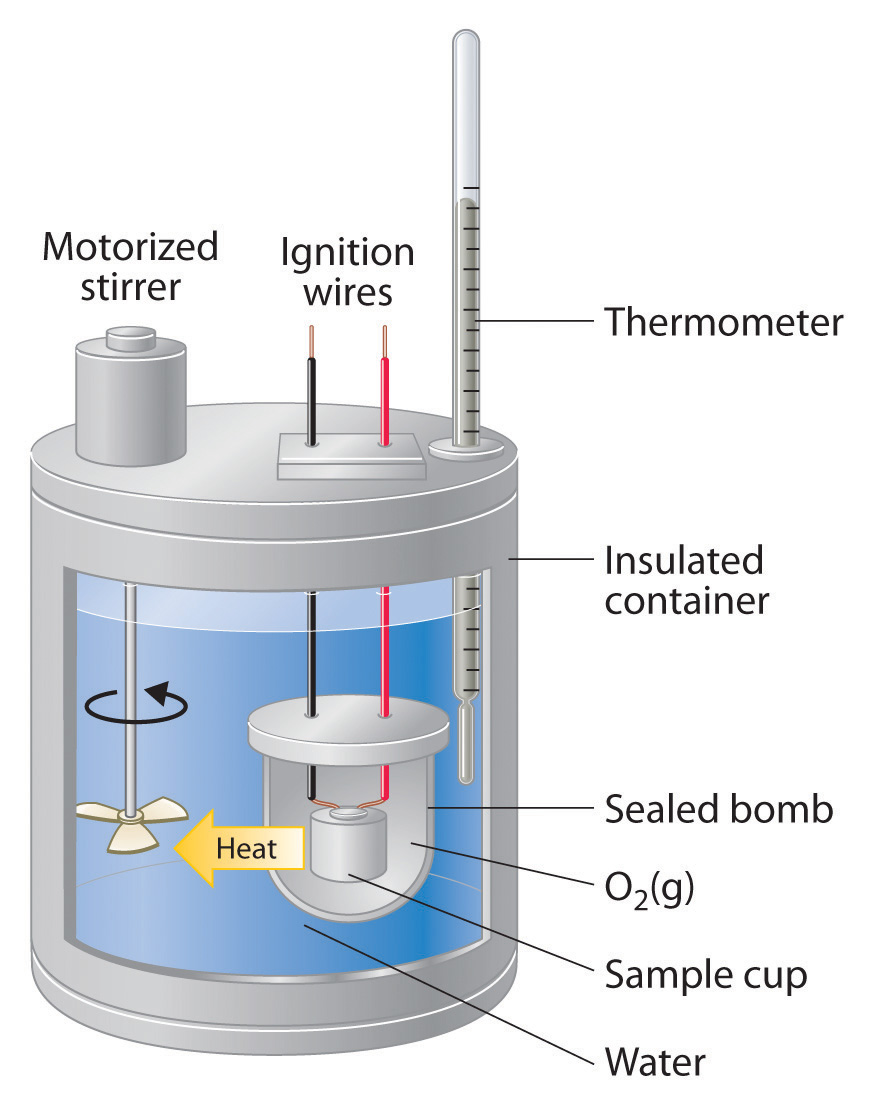
Calorimetría de bombas
La calorimetría de bombas se utiliza predominantemente para medir el calor evolucionado en las reacciones de combustión, pero puede usarse para una amplia variedad de reacciones. Aquí se muestra una típica instalación de calorimetría de bombas. La reacción está contenida en un contenedor metálico pesado (la bomba) obligando a que la reacción se produzca a volumen constante. Como tal, el calor evolucionado (o absorbido) por la reacción es igual al cambio en la energía interna (D U rxn). Luego, la bomba se sumerge en una cantidad reproducible de agua, cuya temperatura se monitorea con un termómetro de alta precisión.
Para las reacciones de combustión, la bomba se cargará con una pequeña muestra del compuesto a ser quemada, y luego la bomba se llena con una alta presión (típicamente alrededor de 10 atm) de O 2. La reacción se inicia suministrando calor usando un trozo corto de cable resistivo que lleva una corriente eléctrica.
El calorímetro debe ser calibrado llevando a cabo una reacción para la cual\(\Delta U_{rxn}\) es bien conocida, de manera que el cambio de temperatura resultante pueda estar relacionado con la cantidad de calor liberado o absorbido. Una reacción de uso común es la combustión de ácido benzoico. Esto hace una buena elección ya que el ácido benzoico reacciona de manera confiable y reproducible en condiciones normales de calorimetría de bombas. El “equivalente de agua” del calorímetro se puede calcular a partir del cambio de temperatura usando la siguiente relación:
\[W = \dfrac{n\Delta U_c +e_{wrire}+e_{other}}{\Delta T}\]
donde n es el número de moles de ácido benzoico utilizados,\(\Delta U_c\) es la energía interna de combustión para el ácido benzoico (3225.7 kJ mol -1 a 25 o C),\(e_{wire}\) representa la energía liberada en la combustión del cable fusible, e otra cuenta para cualquier otra corrección ( como el calor liberado debido a la combustión del nitrógeno residual en la bomba), y D T es el cambio de temperatura medido en el baño de agua circundante.
Una vez que se determina el “equivalente de agua” para un calorímetro, el cambio de temperatura se puede utilizar\(\Delta U_c\) para encontrar un compuesto desconocido a partir del cambio de temperatura creado tras la combustión de una cantidad conocida de la sustancia.
\[ \Delta U_c = \dfrac{W \Delta T - e_{wire} - e_{other}}{n_{sample}}\]
El experimento anterior se conoce como “calorimetría de bomba isotérmica” ya que todo el conjunto se asienta en un laboratorio de temperatura constante. Otro enfoque es emplear “calorimetría adiabática de bomba” en la que el conjunto se asienta dentro de una camisa de agua, cuya temperatura se controla para que coincida con la temperatura del agua dentro del contenedor aislado. Al igualar esta temperatura, no hay gradiente térmico y, por lo tanto, no hay fugas de calor dentro o fuera del ensamblaje durante un experimento (y por lo tanto el experimento es efectivamente “adiabático”).
Encontrar\(\Delta U_c\)
La entalpía de combustión se puede calcular a partir del cambio de energía interna si se conoce la reacción química equilibrada. Recordar de la definición de entalpía
\[\Delta H = \Delta U + \Delta (pV)\]
y si los reactivos y productos en fase gaseosa pueden ser tratados como gases ideales (\(pV = nRT\))
\[\Delta H = \Delta U + RT \Delta n_{gas}\]
a temperatura constante. Para la combustión de ácido benzoico a 25 o C
\[\ce{C6H5COOH (s) + 15/2 O_2(g) -> 7 CO2(g) + 3 H2O(l)} \]
se puede observar que\(\Delta n_{gas}\) es -0.5 mol de gas por cada mol de ácido benzoico reaccionado.
Ejemplo\(\PageIndex{1}\): Combustion of Naphthalene
Un estudiante quemó una muestra de 0.7842 g de ácido benzoico (\(\ce{C7H6O2}\)) en un calorímetro de bomba inicialmente a 25.0 o C y vio un aumento de temperatura de 2.02 o C. Luego quemó una muestra de 0.5348 g de naftaleno (\(\ce{C10H8}\)) (nuevamente a partir de una temperatura inicial de 25 o C) y vio una aumento de temperatura de 2.24 o C. A partir de estos datos, calcular\(\Delta H_c\) para naftaleno (suponiendo que e alambre y e otro no son importantes.)
Solución:
Primero, el equivalente de agua:
\[W = \dfrac{\left[ (0.7841\,g) \left(\frac{1\,mol}{122.124 \, g} \right)\right] (3225.7 \,kJ/mol)}{2.02 \,°C} = 10.254 \, kJ/°C \nonumber\]
Luego\(\Delta U_c\) para la muestra:
\[\Delta H_c = \dfrac{(10.254\, kJ/\,°C)(2.24\,°C )}{(0.5308 \,g)\left(\frac{1\,mol}{128.174 \, g} \right) } = 5546.4 \, kJ/°C \nonumber\]
\(\Delta H_c\)es entonces dado por
\[\Delta H_c = \Delta U_c + RT \Delta n_{gas} \nonumber\]
La reacción para la combustión de naftaleno a 25 o C es:
\[\ce{ C10H8(s) + 12 O2(g) -> 10 CO2(g) + 4 H2O(l)} \nonumber\]
con\(\Delta n_{gas} = -2\).
Entonces
\[ \Delta H_c = 5546.4 \,kJ/mol + \left( \dfrac{8.314}{1000} kJ/(mol \, K) \right) (298 \,L) (-2) = 5541\, kJ/mol \nonumber\]
El valor de la literatura (Balcan, Arzik, & Altunata, 1996) es 5150.09 kJ/mol. ¡Así que eso no está muy lejos!


