7.1: Termodinámica de Mezcla
- Page ID
- 72511
Un lugar natural para iniciar una discusión de mezclas es considerar una mezcla de dos gases. Considerar muestras de los dos gases llenando dos tabiques en un solo contenedor, ambos a la misma presión, temperatura, teniendo volúmenes\(V_A\) y\(V_B\).

Después de dejarse mezclar isotérmicamente, las presiones parciales de los dos gases disminuirán en un factor de 2 (aunque la presión total seguirá siendo el valor original) y los volúmenes ocupados por los dos gases se duplicarán.

Entalpía de Mezcla
Asumiendo un comportamiento ideal, para que las interacciones entre moléculas de gas individuales no sean importantes, es bastante fácil calcular\ (Delta H) para cada gas, ya que es simplemente una expansión isotérmica. La entalpía total de la mezcla viene dada por
\[\Delta H_{mix} = \Delta H_A + \Delta H_B\]
Y dado que el cambio de entalpía para una expansión isotérmica de un gas ideal es cero,
\[\Delta H_{mix} =0\]
es una conclusión sencilla. Este será el criterio para una mezcla ideal.
En general, las mezclas reales se desviarán de este comportamiento ideal limitante debido a las interacciones entre moléculas y otras preocupaciones. Además, muchas sustancias sufren cambios químicos cuando se mezclan con otras sustancias. Pero por ahora, nos limitaremos a discutir mezclas en las que no se produzcan reacciones químicas.
Entropía de Mezcla
El cambio de entropía inducido por la mezcla isotérmica (suponiendo nuevamente que no haya interacciones entre las moléculas en la mezcla gaseosa) volverá a ser la suma de las contribuciones de las expansiones isotérmicas de los dos gases. Afortunadamente, los cambios de entropía para expansiones isotérmicas son fáciles de calcular para los gases ideales.
\[\Delta S = nR \ln \left( \dfrac{V_2}{V_1}\right) \]
Si utilizamos los volúmenes iniciales V A y V B para los volúmenes iniciales de los gases A y B, el volumen total después de la mezcla es\(V_A + V_B\), y el cambio de entropía total es
\[\Delta S_{mix} = n_AR \ln \left( \dfrac{V_A + V_B}{V_A}\right) + n_AR \ln \left( \dfrac{V_A + V_B}{V_B}\right) \]
Señalando que el término
\[ \dfrac{V_A + V_B}{V_A} = \dfrac{1}{\chi_A}\]
donde\(\chi_A\) es la fracción molar de\(A\) después de la mezcla, y que se\(n_A\) puede expresar como el producto de\(\chi_A\) y el número total de moles, la expresión puede ser reescrita
\[\Delta S_{mix} = n_{tot} R \left[ -\chi_A \ln (\chi_A) - \chi_B \ln (\chi_B) \right] \]
Cabe señalar que debido a que la fracción molar siempre está entre 0 y 1, eso\(\ln (\chi_B) < 0\). Como tal, el cambio de entropía para un sistema sometido a mezcla isotérmica siempre es positivo, como cabría esperar (ya que la mezcla hará que el sistema sea menos ordenado).
El cambio de entropía para un sistema sometido a mezcla isotérmica es siempre positivo.
Energía Libre de Mezclar
\(\Delta G_{mix}\)El cálculo no debería ser más difícil que calcular\(\Delta S_{mix}\). Para mezcla isotérmica y presión total constante
\[ \Delta G_{mix} = \Delta H_{mix} - T\Delta S_{mix}\]
y así se deduce de arriba que para la mezcla isotérmica de dos gases a presión total constante
\[\Delta G_{mix} = n_{tot} RT \left[ -\chi_A \ln (\chi_A) + \chi_B \ln (\chi_B) \right] \]
Las relaciones que describen la mezcla isotérmica de dos gases ideales\(A\) y\(B\) se resumen en la gráfica siguiente.
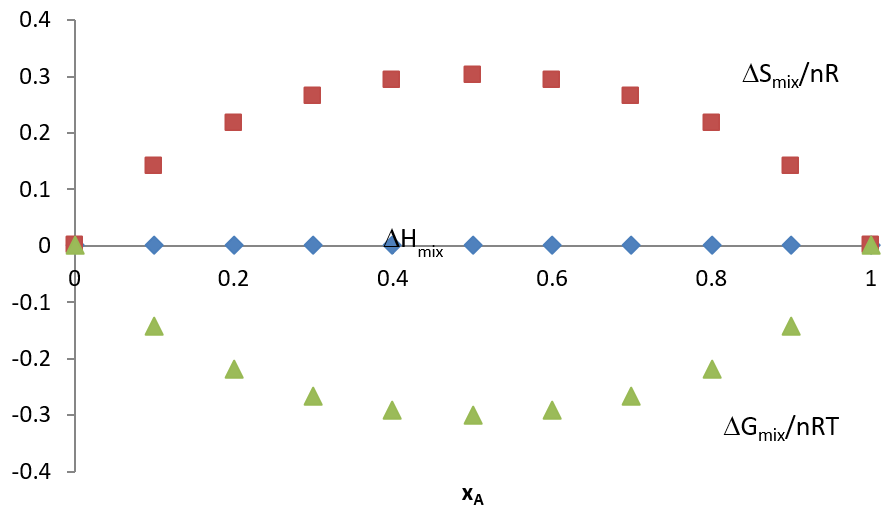
Nuevamente, porque\(\ln (\chi_i) < 0\), entonces\(\Delta G_{mix} < 0\) implicando que la mezcla es siempre un proceso espontáneo para una solución ideal. Esto es cierto para los gases. Pero para muchas combinaciones de líquidos o sólidos, las fuertes fuerzas intermoleculares pueden hacer que la mezcla sea desfavorable (por ejemplo en el caso del aceite vegetal y el agua). Además, estas interacciones pueden hacer que el volumen no sea aditivo también (como en el caso del etanol y el agua).
La mezcla es siempre un proceso espontáneo para una solución ideal.


