9.7: El método de bulbo Dumas para medir el equilibrio de descomposición
- Page ID
- 72292
Un ejemplo clásico de un experimento que se emplea en muchos cursos de laboratorio de química física utiliza un método Dumas Bulb para medir la disociación de N 2 O 4 (g) en función de la temperatura (Mack & France, 1934). En este experimento, se utiliza un bulbo de vidrio para crear un recipiente de volumen constante en el que una sustancia volátil puede evaporarse, o lograr el equilibrio con otros gases presentes. Esto último es de interés en el caso de la reacción
\[N_2O_4(g) \rightleftharpoons 2 NO_2(g) \label{eq1}\]
La reacción es endotérmica, por lo que a temperaturas más altas se observa un mayor grado de disociación.
El procedimiento es calibrar primero el volumen interno de la bombilla Dumas. Esto se hace usando un gas pesado (como SF 6) y comparando la masa de la bombilla cuando se evacua con la masa de la bombilla llena del gas calibrador a una presión y temperatura particulares.
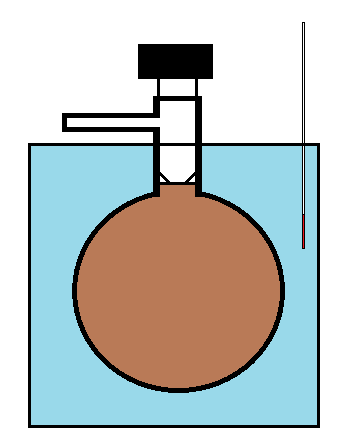
El bulbo Dumas se carga luego con una muestra pura del gas a investigar (como N 2 O 4) y se coloca en un baño termalizado. Entonces se permite llegar al equilibrio. Una vez establecido Equilibrium, se abre la válvula de paso para permitir que el gas escape hasta que la presión interna se ajuste a la presión de la habitación. Luego se cierra la válvula de paso y se pesa el bulbo para determinar la masa total de gas que queda en su interior. El experimento se repite a temperaturas cada vez más altas (de manera que en cada medición posterior, el mayor grado de disociación crea más moléculas de gas y un aumento en la presión en el bulbo (junto con la temperatura más alta), lo que luego conduce a la expulsión de gas cuando la presión es equilibrada.
Luego se determina el grado de disociación en base a la densidad de gas calculada a cada temperatura.
\[ \alpha = \dfrac{\rho_1-\rho_2}{\rho_2(n-1)}\]
donde\(\rho_1\) está la densidad medida y\(\rho_2\) es la densidad teórica si no se produce disociación (calculada a partir de la ley de gas ideal para la temperatura, presión y masa molar dadas del gas de disociación) y\(n\) es el número de fragmentos en los que se disocia el gas disociante (es decir. g.,\(n = 2\) para Ecuación\ req {eq1}). La constante de equilibrio se calcula entonces como
\[ K = \dfrac{4 \alpha^2}{1-\alpha^2} \left( \dfrac{p}{1.00 \,atm} \right)\]
Finalmente, se genera una parcela de van't Hoff para determinar la entalpía de reacción.


