10.4: Entropía de Celdas Electroquímicas
- Page ID
- 72410
La función de Gibbs se relaciona con la entropía a través de su dependencia de la temperatura
\[ \left( \dfrac{\partial \Delta G}{\partial T} \right)_p = - \Delta S\]
Se puede derivar una relación similar para la varianza de temperatura de\(E^o\).
\[ nF \left( \dfrac{\partial E^o}{\partial T} \right)_p = \Delta S \label{eq2}\]
Considere los siguientes datos para la célula Daniel (Buckbeei, Surdzial, & Metz, 1969) que se define por la siguiente reacción
\[Zn(s) + Cu^{2+}(aq) \rightleftharpoons Zn^{2+}(aq) + Cu(s)\]
| T (°C) | 0 | 10 | 20 | 25 | 30 | 40 |
|---|---|---|---|---|---|---|
| Eo (V) | 1.1028 | 1.0971 | 1.0929 | 1.0913 | 1.0901 | 1.0887 |
De un ajuste de los datos a una función cuadrática, la dependencia de la temperatura de
\[\left( \dfrac{\partial E^o}{\partial T} \right)_p \]
se establece fácilmente.
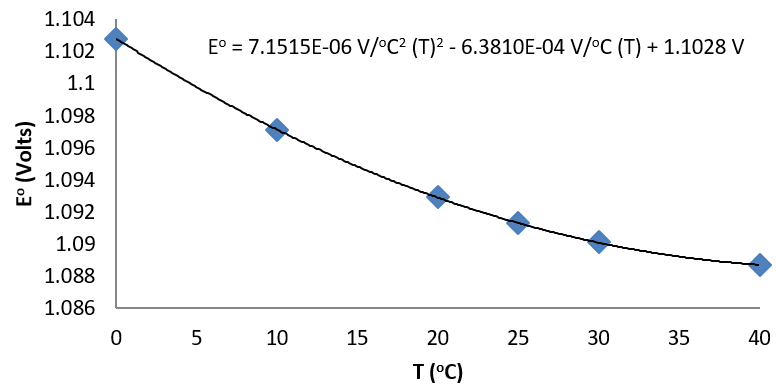
El ajuste cuadrático a los datos da como resultado
\[\left( \dfrac{\partial E^o}{\partial T} \right)_p = 3.8576 \times 10^{-6} \dfrac{V}{°C^2}(T) - 6.3810 \times 10^{-4} \dfrac{V}{°C}\]
Entonces, a 25 °C,
\[\left( \dfrac{\partial E^o}{\partial T} \right)_p = -54166 \times 10^{-4} V/K\]
señalando que se\(K\) puede sustituir\(°C\) ya que en diferencia tienen la misma magnitud. Entonces se calcula el cambio de entropía (Ecuación\ ref {eq2}) es
\[ \Delta S = nF \left( \dfrac{\partial E^o}{\partial T} \right)_p = (2\,mol)(95484\,C/mol) (-5.4166 \times 10^{-4} V/K)\]
Porque
\[ 1\,C \times 1\,V = 1\,J\]
El cambio de entropía estándar para la reacción celular Daniel a 25 °C es
\[ \Delta S = -104.5\, J/(mol\,K).\]
Es el cambio negativo de entropía lo que conduce a un aumento en el potencial celular estándar a temperaturas más bajas. Para una reacción como
\[Pb(s) + 2 H^+(aq) \rightarrow Pb^{2+}(aq) + H_2(g)\]
que tiene un gran incremento en la entropía (debido a la producción de un producto en fase gaseosa), el potencial celular estándar disminuye con la disminución de la temperatura. Al ser esta la reacción que se usa en la mayoría de las baterías de los autos, explica por qué puede ser difícil arrancar unos auto en una mañana de invierno muy fría. El tema de la dependencia de la temperatura de varios potenciales celulares estándar es reportado y discutido por Bratsch (Bratsch, 1989).


