10.3: Medias celdas y potenciales de reducción estándar
- Page ID
- 72441
Al igual que\(G\) ella misma, solo se\(E\) puede medir como una diferencia, por lo que se usa una convención para establecer un cero a la escala. Hacia este fin, la convención establece el potencial de reducción del electrodo estándar de hidrógeno (SHE) en 0.00 V.
\[\ce{Zn \rightarrow Zn^{2+} + 2e^{-}} \nonumber\]
wtih\(E_{ox}^o = 0.763\, V\)
\[\ce{2 H^{+} + 2 e^{-} \rightarrow H2 } \nonumber\]
con\(E_{red}^o = 0.000 \,V\)
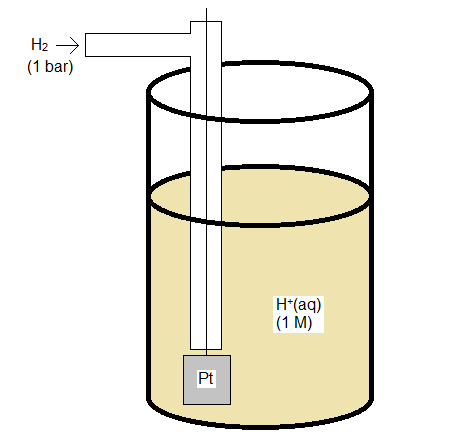
Electrodo de Hidrógeno Estándar
El electrodo de hidrógeno estándar está construido de manera que el gas H2 fluye sobre un electrodo inerte hecho de platino, y puede interactuar con una solución ácida que proporciona H + para la media reacción
\[\ce{2 H^+(aq) + 2 e^{-} -> H_2(g)} \nonumber\]
Tanto H + como H 2 necesitan tener actividad unitaria (o fugacidad), lo que si la solución y el gas se comportan idealmente significa una concentración de 1 M y una presión de 1 bar.
Celdas Electroquímicas
Los potenciales de reducción estándar se pueden medir en relación con la convención de establecer el potencial de reducción del electrodo de hidrógeno estándar (SHE) a cero. En el Cuadro P1 se muestran una serie de valores.
Ejemplo\(\PageIndex{1}\): Cell Potential and Spontaneity
¿Qué par de reactivos producirá una reacción espontánea si todo está presente en su estado estándar a 25 °C?
- \(\ce{Fe}\)y\(\ce{Cu^{2+}}\) o
- \(\ce{Fe^{2+}}\)y\(\ce{Cu}\)
Solución:
Las especies con el potencial de reducción estándar (Cuadro P1) obligarán a la otra a oxidarse.
De la mesa,
\[\ce{Cu^{2+} + 2 e^{-} \rightarrow Cu} \nonumber\]
con\(0.337\, V\)
\[ \ce{Fe^{2+} + 2 e^{-} \rightarrow Fe} \nonumber\]
con\(-0.440\, V\)
Entonces la media reacción de hierro volteará (para que el hierro sea oxidante) y la reacción espontánea en condiciones estándar será
\[Cu^{2+} + Fe \rightarrow Cu + Fe^{2+}\]
con\(E^o = 0.777\, V\)
Cálculo de potenciales celulares
Usando valores medidos en relación con la SHE, es bastante fácil calcular el potencial celular estándar de una reacción dada. Por ejemplo, considere la reacción
\[\ce{ 2 Ag^{+}(aq) + Cu(s) \rightarrow 2 Ag(s) + Cu^{2+}(aq)} \nonumber\]
Antes de calcular el potencial celular, debemos revisar algunas definiciones. La semireacción del ánodo, que se define por la semi-reacción en la que la oxidación °Ccurs, es
\[\ce{Cu(s) \rightarrow Cu^{2+}(aq) + 2 e^{-}} \nonumber\]
Y la semi-reacción catódica, definida como la semi-reacción en la que tiene lugar la reducción, es
\[\ce{Ag^+(aq) + e- \rightarrow Ag(s)}\nonumber\]
Usando la notación celular estándar, se pueden representar las condiciones (como las concentraciones de los iones en solución). En la notación de celda estándar, el ánodo está en el lado izquierdo y el cátodo a la derecha. Los dos suelen estar separados por un puente de sal, el cual es designado por una doble línea vertical. Una sola línea vertical indica un límite de fase. De ahí que para la reacción anterior, si los iones de plata están a una concentración de 0.500 M, y los iones de cobre (II) están a una concentración de 0.100 M, la notación celular estándar sería
Ejemplo\(\PageIndex{2}\): Cell Potential Under nonstadard Conditions
Calcular el potencial celular a 25 °C para la celda indicada por
\[\ce{Cu(s) | Cu^{2+}(aq, \,0.100\, M) || Ag^+ (aq,\, 0.500\, M) | Ag(s)} \nonumber\]
Solución:
Para calcular el potencial celular (\(E\)), primero se debe obtener el potencial celular estándar. El potencial celular estándar a 25 °C viene dado por
\[\begin{align*} E_{cell} = E^o_{cathode} -E^o_{anode} \\[4pt] &= 0.799 \,V - 0.337\,V \\[4pt] &=0.462\,V \end{align*}\]
Y para una celda en condiciones no estándar, como las indicadas anteriormente, se puede utilizar la ecuación de Nernst para calcular el potencial celular. A 25 °C, el potencial celular viene dado por
\[ \begin{align*} E_{cell} &= E^o_{cell} - \dfrac{RT}{nF} \ln \left( \dfrac{[Cu^{2+}]}{[Ag^+]} \right) \\[4pt] &= 0.462\,V - \dfrac{(8.314 \,J/(mol\,K) (298\,K) }{2(96484\,C)} \ln \left( \dfrac{0.100\,M}{0.500\,M} \right) \end{align*}\]
Observando que\(1\, J/C = 1\, V\),
\[E = 0.483\,V \nonumber\]
Ejemplo\(\PageIndex{3}\): Cell Potential under Non-Standard Conditions
Calcular el potencial celular a 25 °C para la celda definida por
\[Ni(s) | Ni^{2+}\, (aq, \,0.500\, M) || Cu(s) | Cu^{2+}(aq, \,0.100\, M)\]
Solución:
Usaremos la ecuación de Nernst. Primero, tenemos que determinar\(E^o\). Usando la Tabla P1, es evidente que
\[ \ce{Cu^{2 }+ 2 e^{-} \rightarrow Cu } \nonumber\]
\(E^o = 0.337 \,V\)
\[\ce{ Ni^{2+} + 2 e^{-} \rightarrow Ni} \nonumber \]
con\(E^o = -0.250\, V\)
Por lo que el cobre, teniendo el mayor potencial de reducción será la semireacción del cátodo al tiempo que obliga al níquel a oxidarse, convirtiéndolo en el ánodo. Entonces E o para la celda será dada por
\[ \begin{align*} E_{cell} &= E^o_{cathode} -E^o_{anode} \\[4pt] &= 0.337 \,V -(-0.250\,V) \\[4pt] = 0.587\,V \end{align*}\]
Y el potencial celular viene dado entonces por la Ecuación de Nernst
\[ \begin{align*} E_{cell} &= E^o_{cell} - \dfrac{RT}{nF} \ln Q \\[4pt] &= 0.587 - \dfrac{(8.314 \,J/(mol\,K) (298\,K) }{2(96484\,C)} \ln \left( \dfrac{0.500\,M}{0.100\,M} \right) \\[4pt] &= 0.566\,V \end{align*}\]
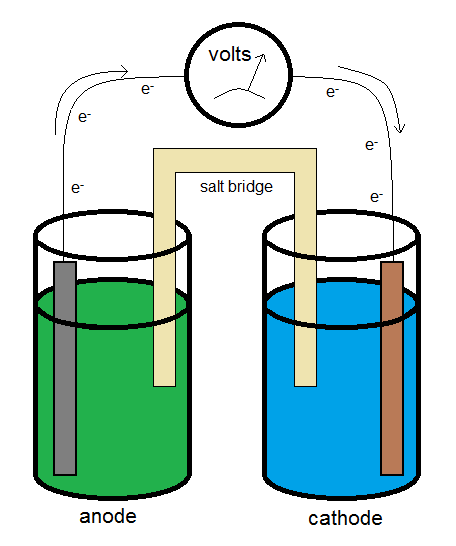
Medición del voltaje
Se puede construir una celda electroquímica galvánica típica similar a lo que se muestra en el diagrama anterior. Los electrones fluyen desde el ánodo (la fuente de electrones) al cátodo (el sumidero de electrones). El puente salino permite que el flujo de iones complete el circuito mientras minimiza la introducción de un potencial de unión.