12.11: Reacciones oscilantes
- Page ID
- 72525
En la mayoría de los casos, la conversión de los reactivos en productos es un proceso bastante suave, ya que las concentraciones de los reactivos disminuyen de manera regular, y las de los productos aumentan de manera regular similar. Sin embargo, algunas reacciones pueden mostrar un comportamiento irregular al respecto. Uno particularmente peculiar (¡pero interesante!) fenómeno es el de las reacciones oscilantes, en las que las concentraciones de reactivos pueden subir y bajar a medida que avanza la reacción. Una forma en que esto puede suceder es cuando los productos de la reacción (o una de las etapas) catalizan la reacción (o una de las etapas). Este proceso se llama autocatálisis.
Un ejemplo de un mecanismo autocatalizado es el mecanismo Lotka-Voltera. Este es un mecanismo de tres pasos definido de la siguiente manera:
\[ A +X \xrightarrow{k_1} X + X\]
\[ X +Y \xrightarrow{k_2} Y + Y\]
\[ Y \xrightarrow{k_3} B\]
En esta reacción, la concentración de reactivo\(A\) se mantiene constante añadiéndolo continuamente a la mezcla de reacción. El primer paso es autocatalizado, por lo que a medida que avanza, se acelera. Sin embargo, un aumento en la producción de\(X\) por la primera reacción también aumenta la velocidad de la segunda reacción, que también es autocatalizada. Finalmente, la eliminación de\(Y\) a través de la tercera reacción pone las cosas a un alto, hasta que la primera reacción puede volver a producir una acumulación de\(X\) para comenzar el ciclo de nuevo.
Una gráfica de la concentración de\(X\) y\(Y\) como función del tiempo se ve de la siguiente manera:
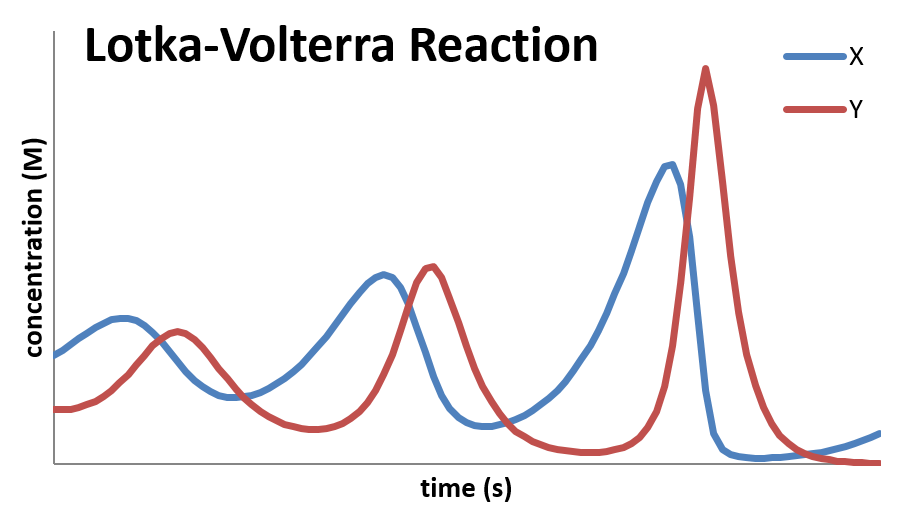
Este mecanismo sigue la cinética predicha por lo que se llama la relación depredador-presa. En este caso,\(X\) representa a la “presa” y\(Y\) representa al “depredador”. La población del depredador no puede acumularse a menos que haya una población significativa de presas de la que puedan alimentarse los depredadores. De igual manera, la población de depredadores disminuye cuando cae la población de la presa. Y finalmente, hay un rezago, ya que el aumento y disminución de la población presa controla el ascenso y la caída de la población depredadora. Las ecuaciones han sido ampliamente estudiadas y tienen aplicaciones no solo en cinética química, sino en biología, economía y otros lugares. ¡Uno se pregunta si las ecuaciones se pueden aplicar para ayudar a entender la política!


