12.10: Catálisis
- Page ID
- 72538
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Hay muchos ejemplos de reacciones que involucran catálisis. Uno que es de importancia actual para la química del ambiente es la descomposición catalítica del ozono (Fahey, 2006). La reacción general
\[ O_3 + O^{\cdot} \xrightarrow{} 2 O_2\]
puede ser catalizado por cloro atómico por el siguiente mecanismo.
\[ O_3 + Cl \xrightarrow{k_1} ClO + O_2\]
\[ ClO + O \xrightarrow{k_1} Cl + O_2\]
La tasa de cambio de la concentración intermedia (\(ClO\)) viene dada por
\[ \dfrac{[ClO]}{dt} = k_1 [ O_3][Cl] - k_2 [ClO][O]\]
Aplicando la aproximación de estado estacionario a esta relación y resolviendo para\([ClO]\) produce
\[ClO] =\dfrac{[O_3][Cl]}{k_2[O]} \label{clo}\]
La velocidad de producción de\(O_2\) (que es dos veces la velocidad de la reacción) viene dada por
\[\dfrac{d[O_2]}{dt} = k_2[O_3][Cl] + k_2[ClO][O]\]
Sustituir la expresión por\([ClO]\) (Ecuación\ ref {clo}) en la expresión anterior produce
\[\dfrac{d[O_2]}{dt} = k_2[O_3][Cl] + k_2 \left(\dfrac{[ O_3][Cl]}{k_2[O]} \right) [O]\]
\[ = k_1 [O_3[Cl] + k_1[O_3][Cl]\]
\[ = 2k_1[O_3][Cl]\]
Y así se predice que la velocidad de reacción sea de primer orden en\([O_3]\), primer orden en el catalizador\([Cl]\), y segundo orden general.
\[\text{rate} = k[O_3][Cl]\]
Si la concentración del catalizador es constante, la cinética de reacción se reducirá a primer orden.
\[\text{rate} = k[O_3]\]
Este ciclo catalítico se puede representar en el siguiente diagrama:
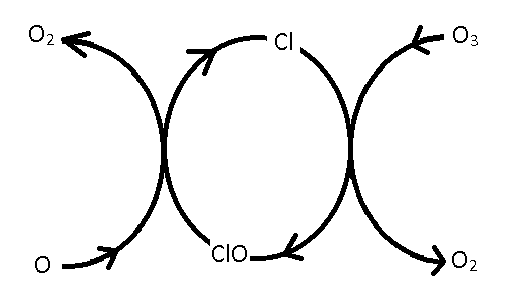
A la izquierda, el oxígeno atómico recoge un átomo de oxígeno\(ClO\) para formar\(O_2\) y generar un\(Cl\) átomo, que luego puede reaccionar con\(O_3\) para formar\(ClO\) y una\(O_2\) molécula. El bucle cerrado en el medio es característico del ciclo catalítico que involucra\(Cl\) y\(ClO\). Además, dado que\(Cl\) actúa como catalizador, puede descomponer muchas\(O_3\) moléculas sin degradarse a través de reacciones secundarias.
La introducción de átomos de cloro en la atmósfera superior es un problema ambiental importante, lo que lleva al adelgazamiento anual y la eventual apertura de la capa de ozono sobre la Antártida. La fuente de cloro proviene de la descomposición de los clorofluorocarbonos los cuales son demandados como refrigerantes y propulsores debido a su increíble estabilidad cerca de la superficie terrestre. Sin embargo, en la atmósfera superior, estos compuestos son sometidos a radiación ultravioleta emitida por el sol y se descomponen para formar los radicales responsables de la descomposición catalítica del ozono. La comunidad mundial abordó este tema redactando el Protocolo de Montreal (Secretaría, 2015), que se centró en la emisión de compuestos destructores del ozono. El resultado de esta acción ha traído evidencia de la cicatrización del agujero de ozono antártico (K, 2015). Este es un muy buen ejemplo de políticas políticas, industriales y económicas guiadas por la ciencia que conducen a cambios positivos para nuestro entorno.


