9.10: Teoría Orbital Molecular Predice que el Oxígeno Molecular es Paramagnético
- Page ID
- 79890
- Describir la conexión entre el orden de enlace, la longitud del enlace y la energía de enlace en moléculas diatómicas
- Explicar las propiedades paramagnéticas observadas del oxígeno molecular con la teoría de Orbitales Moleculares
En los cursos de química general, los estudiantes aprenden que los enlaces covalentes pueden venir como enlaces simples, dobles o triples, los cuales se identifican por su orden de enlace. Tanto la longitud del enlace como la energía del enlace cambian a medida que aumenta el orden del enlace y a medida que aumenta el número de electrones compartidos entre dos átomos en una molécula, aumenta el orden de enlace de un enlace, aumenta la fuerza del enlace y disminuye la distancia entre núcleos (Tabla 9.10.1 ).
| Bond | Orden de Fianza | Entalpía de enlace (kJ/mol) | Longitud de enlace (Å) |
|---|---|---|---|
| \(\ce{C-C}\) | 1 | 348 | 1.54 |
| \(\ce{C=C}\) | 2 | 614 | 1.34 |
| \(\ce{C#C}\) | 3 | 839 | 1.20 |
| \(\ce{N-N}\) | 1 | 163 | 1.47 |
| \(\ce{N=N}\) | 2 | 418 | 1.24 |
| \(\ce{N#N}\) | 3 | 941 | 1.10 |
La tendencia anterior se puede observar en la primera fila diatómica en la Figura 9.10.1 . El orden de enlace se puede determinar directamente a partir de las configuraciones de electrones orbitales moleculares. Para la diatomía, las ocupaciones pueden correlacionarse con la longitud del enlace, las energías de enlace (Figura 9.10.1 ).
Las tendencias en la Figura 9.10.1 y la Tabla 9.10.1 se extienden a los iones moleculares.
Organizar las siguientes cuatro especies de oxígeno molecular en orden de aumentar la longitud del enlace:\(\ce{O_2^+}\)\(\ce{O_2}\),\(\ce{O_2^-}\),, y\(\ce{O_2^{2-}}\).
Solución
La longitud del enlace en las especies de oxígeno puede explicarse por las posiciones de los electrones en la teoría orbital molecular. Para obtener el diagrama de nivel de energía orbital molecular para\(\ce{O2}\), necesitamos colocar 12 electrones de valencia (6 de cada átomo O) en el diagrama de nivel de energía que se muestra en la Figura 9.10.1 . Volvemos a llenar los orbitales según las reglas de Hund y el principio Pauli, comenzando por el orbital que es más bajo en energía. Se necesitan dos electrones cada uno para llenar los orbitales σ 2 s y σ 2 s *, dos más para llenar el\( \sigma _{2p_{z}} \) orbital y 4 para llenar los orbitales degenerados\( \pi _{2p_{x}}^{\star }\) y\( \pi _{2p_{y}}^{\star}\) orbitales. Según la primera regla de Hund, los 2 últimos electrones deben colocarse en\(π^*\) orbitales separados con sus espines paralelos, dando una multiplicidad de 3 (un estado triplete) con dos electrones desapareados. Esto lleva a un orden de bonos predicho de
\[\dfrac{8 − 4}{2} = 2 \nonumber \]
que corresponde a un doble enlace, de acuerdo con los datos experimentales: la longitud del enlace O—O es 120.7 pm, y la energía del enlace es 498.4 kJ/mol a 298 K.
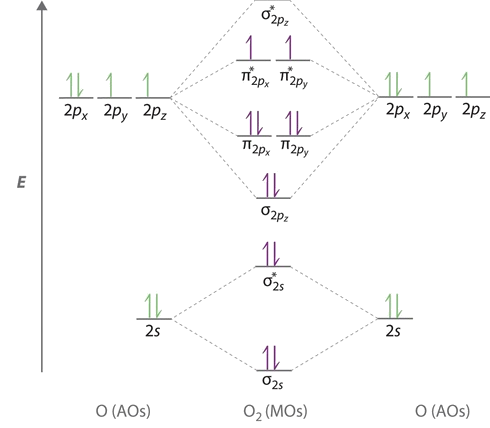
El orden de enlace se determina a partir de las configuraciones de electrones. Las configuraciones de electrones para las cuatro especies se contrastan a continuación.
- \(\ce{O_2}\):\[σ_{1s}^2 {σ^*_{1s}}^2 σ_{2s}^2 {σ^*_{2s}}^2 σ_{2p}^2 π_{2p_y}^2 {π^*_{2p_y}}^2 π_{2p_x}^1 {π^*_{2p_y}}^1 \nonumber \] De la Ecuación\ ref {BO}, el orden de enlace para\(\ce{O_2}\) es 2 (es decir, un doble enlace).
- \(\ce{O_2^{+}}\):\[σ_{1s}^2 {σ^*_{1s}}^2 σ_{2s}^2 {σ^*_{2s}}^2 σ_{2p}^2 π_{2p_y}^2 {π^*_{2p_y}}^2 π_{2p_x}^1 {π^*_{2p_y}}^0 \nonumber \] De la Ecuación\ ref {BO}, el orden de bonos para\(\ce{O_2^{+}}\) es 2.5. Una configuración alternativa e igualmente válida es\[σ_{1s}^2 {σ^*_{1s}}^2 σ_{2s}^2 {σ^*_{2s}}^2 σ_{2p}^2 π_{2p_y}^2 {π^*_{2p_y}}^2 π_{2p_x}^0 {π^*_{2p_y}}^1 \nonumber \]
- \(\ce{O_2^{-}}\):\[σ_{1s}^2 {σ^*_{1s}}^2 σ_{2s}^2 {σ^*_{2s}}^2 σ_{2p}^2 π_{2p_y}^2 {π^*_{2p_y}}^2 π_{2p_x}^2 {π^*_{2p_y}}^1 \nonumber \] De la Ecuación\ ref {BO}, el orden de bonos para\(\ce{O_2^{-}}\) es 1.5. Una configuración alternativa e igualmente válida es\[σ_{1s}^2 {σ^*_{1s}}^2 σ_{2s}^2 {σ^*_{2s}}^2 σ_{2p}^2 π_{2p_y}^2 {π^*_{2p_y}}^2 π_{2p_x}^1 {π^*_{2p_y}}^2 \nonumber \]
- \(\ce{O_2^{2-}}\):\[σ_{1s}^2 {σ^*_{1s}}^2 σ_{2s}^2 {σ^*_{2s}}^2 σ_{2p}^2 π_{2p_y}^2 {π^*_{2p_y}}^2 π_{2p_x}^2 {π^*_{2p_y}}^2 \nonumber \] De la Ecuación\ ref {BO}, el orden de bonos para\(\ce{O_2^{2-}}\) es 1.
El orden de unión disminuye y la longitud del enlace aumenta en el orden. El orden predicho de longitud de enlace creciente entonces es\(\ce{O_2^+}\) <\(\ce{O_2}\) <\(\ce{O_2^-}\) <\(\ce{O_2^{2-}}\). Esta tendencia se confirma experimentalmente con\(\ce{O_2^+}\) (112.2 pm),\(\ce{O_2}\) (121pm),\(\ce{O_2^-}\) (128pm) y\(\ce{O_2^{2-}}\) (149pm).
El oxígeno molecular es paramagnético
Pasamos ahora a una descripción orbital molecular de la unión en\(\ce{O2}\). Se da la circunstancia de que la descripción orbital molecular de esta molécula proporcionó una explicación para un rompecabezas de larga data que no pudo explicarse usando otros modelos de unión. Ninguno de los otros modelos de unión (por ejemplo, la teoría de Valence Bond o la unión de Lewis) puede predecir la presencia de dos electrones desapareados en\(\ce{O_2}\). Los químicos se habían preguntado durante mucho tiempo por qué, a diferencia de la mayoría de las otras sustancias, el líquido\(\ce{O_2}\) es atraído hacia un campo Como se muestra en Video 9.10.1 , en realidad permanece suspendido entre los polos de un imán hasta que el líquido hierve. La única manera de explicar este comportamiento era\(\ce{O_2}\) tener electrones desapareados, convirtiéndolo en paramagnético. Este resultado fue uno de los primeros triunfos de la teoría orbital molecular sobre los otros enfoques de unión.
Las propiedades magnéticas de no\(\ce{O2}\) son solo una curiosidad de laboratorio; son absolutamente cruciales para la existencia de la vida. Debido a que la atmósfera terrestre contiene 20% de oxígeno, todos los compuestos orgánicos, incluidos los que componen los tejidos de nuestro cuerpo, deben reaccionar rápidamente con el aire para formar H 2 O, CO 2 y N 2 en una reacción exotérmica. Afortunadamente para nosotros, sin embargo, esta reacción es muy, muy lenta. La razón de la inesperada estabilidad de los compuestos orgánicos en una atmósfera de oxígeno es que prácticamente todos los compuestos orgánicos, así como H 2 O, CO 2 y N 2, tienen solo electrones emparejados, mientras que el oxígeno tiene dos electrones desapareados. Así, la reacción de\(\ce{O2}\) con compuestos orgánicos para dar H 2 O, CO 2 y N 2 requeriría que al menos uno de los electrones\(\ce{O2}\) cambiara su espín durante la reacción. Esto requeriría un gran aporte de energía, un obstáculo que los químicos llaman barrera de espín.

