9.15: Símbolos de Término Molecular Designan Simetría
- Page ID
- 79878
Los números cuánticos para las moléculas diatómicas son similares a los números cuánticos atómicos. Tenga cuidado, porque las reglas para encontrar las posibles combinaciones son diferentes. El número cuántico de momento angular orbital total Para el caso molecular, este número se llama\(Λ\) en lugar de\(L\). Sigue la misma convención de nomenclatura que\(L\), excepto que en lugar de usar mayúsculas en inglés, usa letras griegas mayúsculas:
- \(Λ = 0 \rightarrow Σ \)
- \(Λ = 1 \rightarrow Π\)
- \(Λ = 2 \rightarrow Δ \)
- \(Λ = 3 \rightarrow Φ \)
A diferencia de\(L\), no existe una fórmula general para encontrar las posibles combinaciones de\(Λ\). Hay que examinar los microestados individuales. Esto es más fácil de lo que parece.
- El número cuántico magnético total\(M_L\):\(M_L\) funciona como\(M_l\) con los átomos, excepto que no existe una fórmula para encontrar las combinaciones.
- El número cuántico magnético de giro total\(M_S\):\(M_S\) funciona exactamente igual\(M_s\). Los electrones pueden apuntar con o contra el eje z ‐, y estar en un orbital molecular versus un orbital atómico no cambia esto. \(M_S\)puede variar de\(m_{s1} + m_{s2}\) a\(m_{s1} ‐ m_{s2}\).
Dos nuevas simetrías: paridad y reflexión
Los orbitales moleculares son más complejos que los atómicos y requieren más modificadores para definirlos completamente. La paridad (a veces llamada “inversión”) le indica si el orbital es simétrico o antisimétrico cuando se realiza una operación de inversión. La notación de simetría u y g se utiliza a veces al describir orbitales moleculares. Esto se refiere a la operación de inversión, que requiere comenzar en un punto arbitrario en la órbita, viajar recto por el centro, y luego continuar hacia afuera a igual distancia del centro. El orbital se designa g (para gerade, incluso) si la fase es la misma, y u (para ungerade, desigual) si la fase cambia de signo.
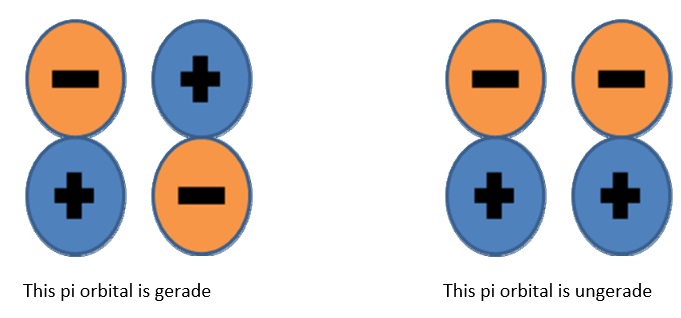
Para determinar si un estado dado es\(g\) o no\(u\), encuentra la paridad de cada electrón de concha abierta individual y usa estos simples (reglas de Laporte):
- \(g + g \rightarrow g \)
- \(g + u \rightarrow u \)
- \(u + u \rightarrow g \)
¿Cuál es la paridad del Estado\(1σ_g^21σ_u^22σ_g^22σ_u^22π_u^12π_u^1\)?
Solución
Dado que ambos electrones de caparazón abierto son ungerade, la paridad general es g. Insinuación útil: los orbitales sigma de unión y los orbitales pi anti ‐ enlaces son siempre gerados. Los sigmas anti-adhesión y los pis de unión son siempre ungerade. Dibujarlos y ver por ti mismo.
La reflexión determina si un orbital dado es simétrico o antisimétrico al reflexionar a través de un plano que contiene ambos núcleos. La elección de los planos de simetría es arbitraria. Siempre y cuando escojas un avión y te quedes con él, siempre obtendrás la respuesta correcta. Cuando un orbital es simétrico, se etiqueta +. Cuando un orbital es anti ‐ simétrico, se etiqueta ‐. Para encontrar el reflejo general de un estado, use estas reglas:
- (+) (+)\ derecha +
- (+) (‐)\ fila derecha ‐
- (‐) (‐)\ fila derecha +
¡La reflexión solo se aplica a los estados σ! Para λ > 0, ¡no hay etiquetas de reflexión! Si experimentas con las reglas, rápidamente te darás cuenta de por qué es así.
¿Cuál es el reflejo del Estado\(1σ_g^21σ_u^22σ_g^22σ_u^22π_u^12π_u^1\)?
Solución
Es necesario saber cómo son los orbitales. Dibuja un cuadro y luego elige un avión. Para este ejemplo, el plano de la página está selcted, pero el plano ortogonal habría funcionado igual de bien.
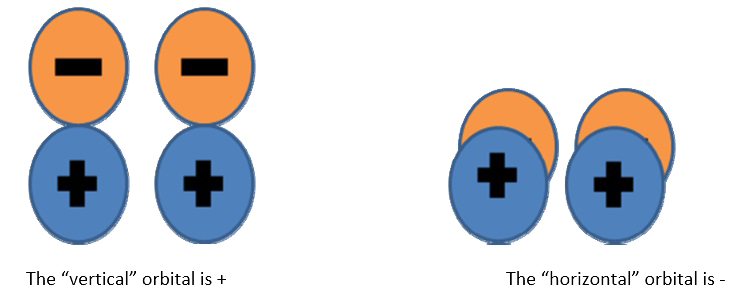
El orbital “vertical” es + El orbital “horizontal” es ‐ Ya que uno es + y uno es ‐, la reflexión general es ‐. Intenta usar el plano ortogonal y convencerte de que sigues obteniendo la misma respuesta.
¿Para qué sirven los símbolos del término\(O_2\)?
Solución
El diagrama orbital molecular para\(O_2\) es
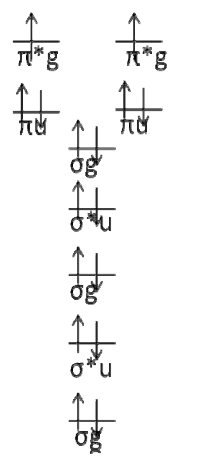
Donde elegí configuraciones arbitrarias para los dos últimos electrones.
Hay dos electrones de caparazón abierto que ocupan los\(π_g\) orbitales antienlace. Estos son los únicos electrones que importan. Es más fácil simplemente dibujar todas las permutaciones y determinar los límites en\(Λ\) y\(M_L\) por inspección. Si hacemos esto, es fácil ver eso\(Λ = 2,0\) y aquello\(M_L = 2,0, ‐ 2\)
| \(M_s= -1\) | \(M_s= 0\) | \(M_s= 2\) |
| 0 | 1 | 0 |
| 1 | 2 | 1 |
| 0 | 1 | 0 |
La fila superior es un\(Λ=2\)\(M_S =0\) estado, así es\(^1Δ\). Ambos electrones están en el orbital más a la derecha. Este orbital es gerade, y (g) (g) = g, por lo que la etiqueta de paridad es g. No asignamos etiquetas de reflexión a estados no σ, por lo que el término símbolo es\(^1Δ_g\). Después de eliminar los microestados usados, el gráfico se convierte en
| \(M_s= -1\) | \(M_s= 0\) | \(M_s= 2\) |
| 1 | 1 | 0 |
Este es un estado λ =0 con tres posibles configuraciones de giro, así es\(^3Σ\). Sabemos que los electrones están en diferentes sub‐orbitales (si no puedes ver esto, intenta dibujar todas las combinaciones posibles que den\(Λ =0\)). Ambos orbitales son gerade, por lo que la paridad general es gerade. Uno de los orbitales será +, el otro será ‐. La respuesta final es\(^1Δ_g \(^3Σ^+_g\)
Escribe los símbolos del término para\(O_2^‐\)
Solución
Primero dibuje el diagrama de configuración electrónica.
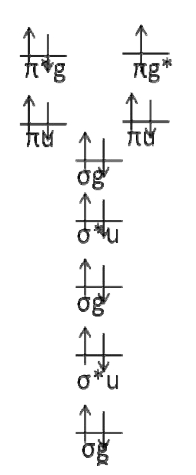
Solo hay dos configuraciones posibles. Debería ser fácil ver que el término símbolo es\(^2\Pi_g\).
Colaboradores y Atribuciones
Mattanjah de Vries (Chemistry, University of California, Santa Barbara)

