10.3: BeH₂ es Lineal y H₂O es Doblada
- Page ID
- 79708
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
En esta sección, construiremos orbitales moleculares aproximados para una molécula de agua considerando un simple triatómico lineal de la forma general\(HXH\), donde\(X\) es un elemento de segunda fila. Tomaremos un enfoque orbital molecular multicéntrico en lugar del enfoque de enlace de valencia bicentral/híbrido discutido anteriormente. Al igual que con discusiones anteriores sobre Orbitales Moleculares, los aproximamos como combinaciones lineales de orbitales atómicos (LCAO). En la teoría orbital molecular, las combinaciones lineales de todos los orbitales (atómicos) disponibles formarán orbitales moleculares. Estos se extienden por toda la molécula, o deslocalizados, y en una interpretación química cuántica se les llama orbitales canónicos. Dado que es absolutamente erróneo suponer que sólo hay tres tipos de orbitales\(sp^x\) híbridos, es posible, que haya múltiples tipos diferentes de orbitales involucrados en la unión para un determinado átomo.
Moléculas AH₂
Queremos construir un argumento razonable para el ordenamiento energético y la estructura de los orbitales moleculares. Primero notamos que cada uno\(H\) donará una\(1s\) órbita en el esquema LCAO, y probablemente\(A\) donará al menos\(2s\) y posibles\(2p\) orbitales, dependiendo de su identidad química. En general, si consideramos solo\(A\) los elementos de la primera fila, los orbitales de la molécula (vía el LCAO) pueden expresarse como combinación de\(1s\) orbitales en los dos Hidrógenos (\(H_1\)y\(H_2\)) y los cuatro orbitales n=2 (\(2s\; 2p_x\; 2p_y; 2p_z\)) en el\(A\) átomo:
\[ | \chi \rangle = a_1 | 1s \rangle _{H_1} + a_2 | 1s \rangle _{H_2} + a_3 | 2s \rangle _{A} + a_4 | 2p_x \rangle _{A} + a_5 | 2p_y \rangle _{A} + a_6 | 2p_z \rangle _{A} \label{MO1} \]
Estos orbitales moleculares fueron creados con seis orbitales atómicos y de ahí se pueden crear seis orbitales\( | \chi \rangle \) moleculares diferentes. Al igual que con problemas orbitales moleculares anteriores, los coeficientes de esta expansión (\(\{a_i\}\)) se determinan resolviendo el determinante secular.
Si consideramos solo\(AH_2\) moléculas lineales, entonces la Ecuación\(\ref{MO1}\) puede simplificarse ignorando\( 2p_x\) y orbitales\(2p_y\) atómicos ya que son perpendiculares a los enlaces y por lo tanto son no enlazantes (solo para\(AH_2\) moléculas lineales). Además, la molécula es simétrica alrededor del centro (la posición de\(A\)), de ahí que los orbitales tengan que tener la misma simetría.
Sólo el\(2p\) orbital de\(A\) eso se superpondrá con\(1s\) de\(H\) es el\(2p_z\). Por lo tanto, la ecuación\(\ref{MO1}\) puede simplificarse para considerar la combinación
\[ | \chi \rangle = a_1 | 1s \rangle _{H_1} + a_1 | 1s \rangle _{H_2} + a_3 | 2s \rangle _{A} + a_6 | 2p_z \rangle _{A} \label{MO2} \]
Obsérvese que los dos coeficientes frente a los\(1s\) orbitales de hidrógeno son los mismos por simetría. Esto ya que ningún hidrógeno es “especial” y deben tener la misma contribución al orbital molecular.
¿Qué tan grandes deben\(A\) compararse los contribuyentes\(2s\) orbitales de con el\(1s\) orbital de\(H\)?
Esto depende de varias cosas. Primero, es la carga nuclear encendida\(A\) y la segunda es la diferencia de electronegatividad entre\(H\) y\(A\). El primero determina qué tan rápido son los\(2s\) orbitales, recordando que la parte exponencial es\(exp(-Zr/a_0)\), y la diferencia de electronegatividad determina la magnitud relativa de\(H_1\) comparada con\(H_2\).
Los seis orbitales\(| \chi \rangle \) moleculares de la Ecuación se\(\ref{MO1}\) muestran en la Figura 10.3.1 .

El primer orbital molecular\(|\chi_1 \rangle\) construido a partir de la ecuación\(\ref{MO1}\) es puramente enlazante porque el\(2s\) orbital es positivo cerca del\(A\) núcleo, pero se vuelve negativo a medida que nos alejamos del núcleo. Este orbital también es par (simetría garade), por lo que podemos denotarlo como\(2\sigma_{g}\) orbital significando que está construido a partir de un\(2s\) orbital de\(A\) combinado con los dos\(1s\) orbitales de\(H\). El único otro MO que se puede construir que tiene la simetría correcta es el\(|\chi_6 \rangle\) que se denota como\(2\sigma_{u}\). Este es un orbital molecular antiunión y también es uniforme (simetría garade). Las funciones de onda correspondientes son:
\[ | \chi_1 \rangle = a_1 | 1s \rangle _{H_1} + a_1 | 1s \rangle _{H_2} + a_3 | 2s \rangle _{A} \nonumber \]
\[ | \chi_6 \rangle = a_1 | 1s \rangle _{H_1} + a_1 | 1s \rangle _{H_2} - a_3 | 2s \rangle _{A} \nonumber \]
A continuación, si combinamos un\(2p_z\) orbital de\(A\) con el\(1s\) de\(H\), hay dos posibilidades que tienen la simetría correcta. El primero es
\[ | \chi_2 \rangle = a_1 | 1s \rangle _{H_1} + a_1 | 1s \rangle _{H_2} + a_6 | 2p_z \rangle_{A} \nonumber \]
que es un orbital de unión y denotado como\(1\sigma_{u}\). Esto es puramente antiadhesión y tiene una simetría impar (ungarede). La otra combinación es
\[ | \chi_5 \rangle = a_1 | 1s \rangle _{H_1} - a_1 | 1s \rangle _{H_2} + a_6 | 2p_z \rangle_{A} \nonumber \]
De ahí que denotemos esto como\(2\sigma_{g}\). Los orbitales\(2p_x\) y\(2p_y\) de\(X\) son orbitales no vinculantes\(\pi_{2p_x}\) y se convierten en orbitales\(\pi_{2p_y}\) no vinculantes y designados como\(1\pi_u\) orbitales:
\[ | \chi_3 \rangle = | 2p_x \rangle_{A} \nonumber \]
\[ | \chi_4 \rangle = | 2p_y \rangle_{A} \nonumber \]
El hidruro de berilio (\(BeH_2\)) es lineal
Considere la\(BeF_2\) molécula: Be tiene una configuración de\(1s^2\, 2s^2\) electrones con no hay electrones desapareados disponibles para la unión. Desde la perspectiva de utilizar únicamente orbitales atómicos para generar los orbitales de unión, concluimos que la molécula no podría existir ya que no existen orientales libres sobre el\(Be\) enlace. Claramente, los orbitales atómicos no son adecuados para describir orbitales en moléculas, pero esto se puede resolver permitiendo que los orbitales 2s y un 2p en Be se mezclen para formar orbitales\(sp\) híbridos. El ángulo de unión experimental H-Be-H es de 180°. Presumiblemente, un electrón de Be se comparte con cada uno de los electrones desapareados de H. Podríamos promover y electrón desde el orbital 2s en Be al orbital 2p para obtener dos electrones desapareados para la unión (predicando ángulos de enlace de 90°, no 180°). Así, la geometría aún no se explica solo con orbitales atómicos.
Be tiene orbitales 2s y 2p, y está en el medio. H tiene orbitales 1s; hay 2 átomos de H en el exterior. Inicialmente hacemos combinaciones de los orbitales atómicos H que anteriormente usamos para hacer hidrógeno diatómico, excepto que no hay solapamiento (i.e.,\(S=0\)). Estas combinaciones se mezclarán con los 2s y 2p z en Be, como se muestra en la Figura 10.3.2 .
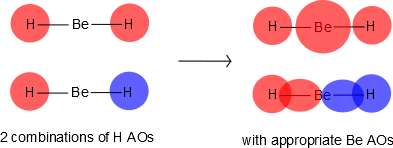
Entonces podemos juntar el diagrama Orbital Molecular, comenzando por el exterior, dibujando en MOs enlazantes, no enlazantes y antiligantes, y llenando los electrones (Figura 10.3.3 ). El orden de fianza es 2.

Los diagramas de Walsh, a menudo llamados diagramas de coordenadas angulares o diagramas de correlación, son representaciones de energías orbitales calculadas de una molécula versus una coordenada de distorsión, utilizadas para hacer predicciones rápidas sobre las geometrías de moléculas pequeñas. Al trazar el cambio en los niveles orbitales moleculares de una molécula en función del cambio geométrico, los diagramas de Walsh explican por qué las moléculas son más estables en ciertas configuraciones espaciales (es decir, por qué el agua adopta una conformación doblada).
Una aplicación importante de los diagramas de Walsh es explicar la regularidad en la estructura observada para moléculas relacionadas que tienen números idénticos de electrones de valencia (es decir, por qué\(\ce{H2O}\) y\(\ce{H2S}\) parecen similares), y explicar cómo las moléculas alteran sus geometrías como su número de electrones o estado de espín cambios. Adicionalmente, los diagramas de Walsh se pueden utilizar para predecir distorsiones de la geometría molecular a partir del conocimiento de cómo el LUMO (Orbital Molecular Desocupado más bajo) afecta al HOMO (Orbital Molecular Ocupado más Alto) cuando la molécula experimenta perturbación geométrica. La regla de Walsh para predecir formas de moléculas establece que una molécula adoptará una estructura que mejor proporcione la mayor estabilidad para su HOMO. Si un cambio estructural particular no perturbe al HOMO, el orbital molecular ocupado más cercano gobierna la preferencia por la orientación geométrica.

Para el sistema\(AH_2\) molecular, Walsh produjo el primer diagrama de correlación angular trazando las curvas de energía orbitales para los orbitales moleculares canónicos mientras cambiaba el ángulo de enlace de 90° a 180° (Figura 10.3.4 ). A medida que se distorsiona el ángulo de enlace, la energía para cada uno de los orbitales puede seguirse a lo largo de las líneas, permitiendo una rápida aproximación de la energía molecular en función de la conformación.
Un resultado de predicción típico para el agua es un ángulo de unión de 90°, que ni siquiera se acerca al valor experimental de 104°. En el mejor de los casos, el método es capaz de diferenciar entre una molécula doblada y una molécula lineal.
La regla de Walsh para predecir formas de moléculas establece que una molécula adoptará una estructura que mejor proporcione la mayor estabilidad para su HOMO. Si un cambio estructural particular no perturbe al HOMO, el orbital molecular ocupado más cercano gobierna la preferencia por la orientación geométrica.
La Figura 10.3.4 ilustra la diferencia entre el caso lineal real que acabamos de analizar y la molécula verdaderamente doblada, e.g\(H_2 O\). La geometría cambia un poco el orden, pero el cuadro cualitativo que obtenemos del caso lineal lo convierte en una construcción útil. Los orbitales atómicos de oxígeno se etiquetan según su simetría (Figura 10.3.5 ) como\(a_1\) para el orbital 2s y\(b_1\) (\(2p_x\)),\(b_2\) (\(2p_y\)) y\(a_1\) (\(2p_z\)) para los tres orbitales 2p. Los dos orbitales de hidrógeno 1s están premezclados para formar\(a_1\) y orbitales\(b_2\) moleculares.

La mezcla tiene lugar entre orbitales de la misma simetría de energía comparable dando como resultado un nuevo conjunto de MO para el agua:
- 2a 1 MO a partir de la mezcla del oxígeno 2s orbital atómico y el hidrógeno σ MO. La mezcla orbital atómica de oxígeno pequeño 2p z fortalece la unión y disminuye la energía orbital.
- 1b 2 MO de la mezcla del oxígeno 2p y orbital atómico y el hidrógeno σ* MO.
- 3a 1 MO de la mezcla del oxígeno 2p z orbital atómico y el hidrógeno σ MO. La pequeña mezcla orbital atómica de oxígeno 2s debilita la unión y eleva la energía orbital.
- 1b 1 MO no enlazante del oxígeno 2p x orbital atómico (el p-orbital perpendicular al plano molecular).
En la molécula de agua el orbital más alto ocupado, (\(1b_1\)) es no enlazante y altamente localizado en el átomo de oxígeno, similar a los orbitales no enlazantes del fluoruro de hidrógeno. El siguiente orbital más bajo (\(2a_1\)) se puede considerar como un orbital sin unión, ya que tiene un lóbulo que apunta lejos de los dos hidrógenos. A partir de los orbitales de unión de menor energía, es posible ver que el oxígeno también toma más que su “parte justa” de la densidad total de electrones. La configuración electrónica del agua en el estado fundamental (Figura 10.3.5 ) es por lo tanto
\[(a_1)^2(b_2)^2(a_1)^2(b_1)^2 \nonumber \]

En la tabla 10.3.1 se enumeran los coeficientes LCAO respectivos para los seis orbitales atómicos. La Tabla 10.3.1 combina los valores de energía con la descripción derivada de la tabla de caracteres para moléculas del grupo puntual C 2v
| Energía | Símbolo | s (H) | s (O) | p x (O) | p y (O) | p z (O) | s (H) |
|---|---|---|---|---|---|---|---|
|
6.728
|
2b 2 |
0.525
|
0
|
0
|
-0.669
|
0
|
-0.525
|
|
5.440
|
3a 1 |
-0.553
|
0.306
|
0
|
0
|
-0.544
|
0.553
|
|
-12.191
|
1b 1 |
0
|
0
|
-1.000
|
0
|
0
|
0
|
|
-14.467
|
2a 1 |
-0.309
|
0.354
|
0
|
0
|
0.827
|
-0.309
|
|
-19.113
|
1b 2 |
-0.473
|
0
|
0
|
-0.743
|
0
|
0.473
|
|
-40.032
|
1a 1 |
0.315
|
0.884
|
0
|
0
|
-0.143
|
0.315
|
Nota en contraste con la teoría del enlace de valencia discutida anteriormente para el agua, los dos pares de electrones solitarios no están en orbitales idénticos. El 1b 1 MO es un par solitario, mientras que los MO 3a 1, 1b 2 y 2a 1 pueden localizarse para dar dos enlaces O−H y un par solitario en el plano. Esto concuerda con el espectro fotoelectrónico medido experimentalmente discutido en la siguiente sección.
Resumen
El diagrama de correlación de Walsh es una gráfica de la energía orbital molecular en función de algún cambio sistemático en la geometría molecular. Por ejemplo, la correlación entre las energías orbitales y el ángulo de enlace para una\(AH_2\) molécula. La geometría de una molécula está determinada por qué estructura posible es la más baja en energía. Podemos usar el diagrama de Walsh para determinar las tendencias energéticas en función de qué orbitales están ocupados.
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

