10.7: Benceno y Aromaticidad
- Page ID
- 79717
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Aplicar la teoría de Hückel para describir la unión pi en el sistema conjugado cíclico
- Identificar el origen de la aromaticidad dentro de la teoría de Hückel para describir la estabilización adicional en ciertos sistemas conjugados cíclicos
En las secciones anteriores se abordaron los\(\pi\) orbitales del sistema lineal conjugado. Aquí abordamos los sistemas conjugados de hidrocarburos conjugados cíclicos con la fórmula general de\(C_nH_n\) donde\(n\) es el número de átomos de carbono en el anillo. La molécula de esta importante clase de molécula orgánica con la que está más familiarizado es el benceno (\(C_6H_6\))\(n=6\), aunque existen muchas otras moléculas como el ciclobutadieno (\(C_4H_4\)) con\(n=4\) (Figura 10.7.1 ).


La estructura del benceno es un tema histórico interesante. En 1865, el químico alemán Friedrich August Kekulé publicó un artículo sugiriendo que la estructura del benceno contenía un anillo de seis átomos de carbono con enlaces simples y dobles alternantes. Dentro de este argumento, se pueden formular dos estructuras de resonancia.

Sin embargo, la difracción de rayos X muestra que los seis enlaces carbono-carbono en el benceno son de la misma longitud, a las 140pm. Las longitudes de enlace C-C son mayores que un doble enlace (135pm), pero más cortas que un enlace sencillo típico (147pm). Esto significa que ninguna de las estructuras Figura 10.7.2 son correctas y la verdadera 'estructura' del benceno es una mezcla de las dos. Como se discutió anteriormente, esa perspectiva de enlace de valencia da como resultado una energía de deslocalización dentro de un enfoque orbital molecular.
Los sistemas aromáticos proporcionan las aplicaciones más significativas de la teoría de Hückel. Para el benceno, encontramos el determinante secular
\[\left|\begin{array}{cccccc}x&1&0&0&0&1\\1&x&1&0&0&0\\0&1&x&1&0&0\\0&0&1&x&1&0\\0&0&0&1&x&1\\1&0&0&0&1&x\end{array}\right|=0\label{31} \]
con las seis raíces\(x=\pm2,\pm1,\pm1\). Esto corresponde a las siguientes energías (ordenadas de la más estable a la menor desde entonces\(\beta < 0\)):
- \(E_1 = α + 2β\)
- \(E_2 = α + β\)
- \(E_3 = α + β\)
- \(E_4 = α − β\)
- \(E_5 = α − β\)
- \(E_6 = α − 2β\)
Los dos pares de niveles de\(E=\alpha\pm\beta\) energía son dos veces degenerados (Figura 10.7.3 ).

Las funciones de onda resultantes están por debajo (expandidas en términos de orbitales\(| 2p\rangle\) atómicos de carbono).
\[ \begin{align} | \psi_1 \rangle &= \dfrac{1}{\sqrt{6}} \left[ | 2p_{z1} \rangle+ | 2p_{z2} \rangle + | 2p_{z3} \rangle + | 2p_{z4} \rangle + | 2p_{z5} \rangle + | 2p_{z6} \rangle \right] \\ | \psi_2 \rangle &= \dfrac{1}{\sqrt{4}} \left[ | 2p_{z2} \rangle + | 2p_{z3} \rangle - | 2p_{z4} \rangle - | 2p_{z5} \rangle \right] \\ | \psi_3 \rangle &= \dfrac{1}{\sqrt{3}} \left[ | 2p_{z1} \rangle + \dfrac{1}{2}| 2p_{z2} \rangle - \dfrac{1}{2} | 2p_{z3} \rangle - | 2p_{z4} \rangle - \dfrac{1}{2} | 2p_{z5} \rangle + \dfrac{1}{2} | 2p_{z6} \rangle \right] \\ | \psi_4 \rangle &= \dfrac{1}{\sqrt{4}} \left[ | 2p_{z2} \rangle - | 2p_{z3} \rangle + | 2p_{z4} \rangle - | 2p_{z5} \rangle \right] \\ | \psi_5 \rangle &= \dfrac{1}{\sqrt{3}} \left[ | 2p_{z1} \rangle - \dfrac{1}{2}| 2p_{z2} \rangle - \dfrac{1}{2} | 2p_{z3} \rangle + | 2p_{z4} \rangle - \dfrac{1}{2} | 2p_{z5} \rangle - \dfrac{1}{2} | 2p_{z6} \rangle \right] \\ | \psi_6 \rangle &= \dfrac{1}{\sqrt{6}} \left[ | 2p_{z1} \rangle- | 2p_{z2} \rangle + | 2p_{z3} \rangle - | 2p_{z4} \rangle + | 2p_{z5} \rangle - | 2p_{z6} \rangle \right] \end{align} \nonumber \]
Cada uno de los carbonos del benceno aporta un electrón a la estructura de\(\pi\) enlace (Figura 10.7.3 ). Esto significa que todos los orbitales moleculares de enlace están completamente ocupados y el benceno tiene una configuración electrónica de\(\pi_1^2 \pi_2^2 \pi_3^2 \). Con los tres orbitales moleculares más bajos ocupados, el total\(\pi\)-bonding energy is
\[E_{tot} (benzene)=2(\alpha+2\beta)+4(\alpha+\beta)=6\alpha+8\beta\label{32} \]
Dado que la energía de un doble enlace localizado es\( 2(\alpha+\beta)\), según se determina a partir del análisis de etileno, la energía de deslocalización del benceno es
\[ \Delta E = E_{tot} (benzene) - 3 E_{tot} (ethylene) = (6\alpha+8\beta ) - 3 \times 2(\alpha+\beta) = 2\beta \nonumber \]
El valor termoquímico experimental es -152 kJ mol -1.
Aromaticidad
En general, los polienos cíclicos son solo de cáscara cerrada (es decir, cada electrón emparejado hacia arriba) y extra estables para con (4n+2)\(\pi\) electrons (n=0,1,2…). These special molecules have the highest delocalization energies and are said to be “aromatic”. Para el benceno esto es\( 2\beta\) (Ecuación\(\ref{32}\)), que es la energía por la cual se deslocalizan\(\pi\) electrons in benzene are more stable than those in three isolated double bonds.
Se obtiene una estructura cíclica conjugada de caparazón cerrado estable para moléculas con (4n+ 2) electrones con n=2, 6, 10,... electrones.
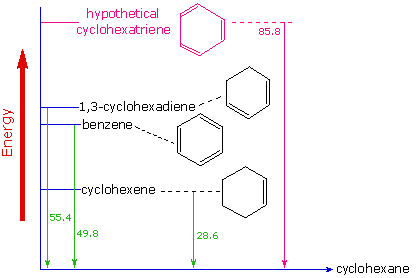
La evidencia de la estabilidad termodinámica mejorada del benceno se obtuvo a partir de mediciones del calor liberado cuando se hidrogenan dobles enlaces en un anillo de seis carbonos (hidrógeno se agrega catalíticamente) para dar ciclohexano como un producto común. En el siguiente diagrama el ciclohexano representa un punto de referencia de baja energía. La adición de hidrógeno al ciclohexeno produce ciclohexano y libera calor que asciende a 11.9 kJ mol -1. Si tomamos este valor para representar el costo energético de introducir un doble enlace en un anillo de seis carbonos, esperaríamos que un ciclohexadieno libere 23.9 kJ mol -1 en la hidrogenación completa, y 1,3,5-ciclohexatrieno para liberar 35.9 kJ mol -1. Estos calores de hidrogenación\(\Delta H_{hyd}\) reflejan la estabilidad termodinámica relativa de los compuestos (Figura 10.7.4 ). En la práctica, el 1,3-ciclohexadieno es ligeramente más estable de lo esperado, en aproximadamente 8.1 kJ mol -1, presumiblemente debido a la conjugación de los dobles enlaces. El benceno, sin embargo, es un extraordinario 15 kJ mol-1 más estable de lo esperado. Esta estabilidad aditonal es una característica de todos los compuestos aromáticos.
Colaboradores y Atribuciones
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
- Wikipedia

