21.5: Las entropías absolutas prácticas se pueden determinar calorimétricamente
- Page ID
- 79777
De la sección 21.1, aprendimos que la entropía a presión constante cambia con la temperatura al:
\[\Delta S=\int_{T_1}^{T_2}{\frac{C_P(T)}{T}dT} \nonumber \]
De la sección 21.3, aprendimos que la entropía de una transición de fase es:
\[\Delta_{trs} S=\frac{\Delta_{trs}H}{T_{trs}} \nonumber \]
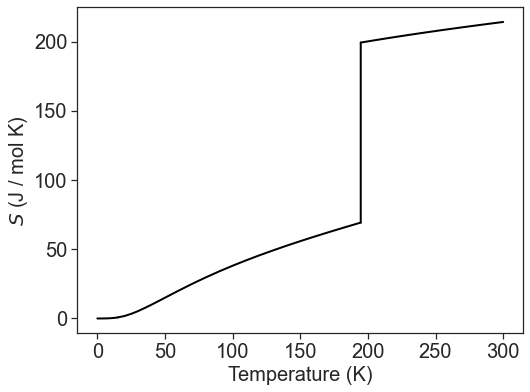
Tanto la capacidad calorífica como la entalpía de transición se pueden determinar experimentalmente mediante calorimetría. Usando valores experimentales con las dos expresiones anteriores y la convención de que la entropía a cero absoluto (0 K) es cero, podemos calcular la entropía absoluta práctica de una sustancia para cualquier temperatura. Por ejemplo, la entropía del gas CO 2 a 300 K puede calcularse mediante:
\[S(T)=\int_{0 K}^{T_{sub}}{\frac{C_P^s(T)}{T}dT}+\frac{\Delta_{sub}H}{T_{sub}}+\int_{T_{sub}}^{300\text{ K}}{\frac{C_P^g(T)}{T}dT} \nonumber \]
Donde la temperatura de sublimación (\(T_{sub}\)) es 194.7 K.