24.1: Una mezcla es una combinación de dos o más sustancias
- Page ID
- 79318
Debido a que mucha química ocurre en mezclas o produce una mezcla, los químicos necesitan considerar la termodinámica de las mezclas. Una mezcla puede consistir en dos gases, dos líquidos, dos sólidos, o incluso un líquido y un gas.
Cantidades parciales y escalado
Consideremos un proceso bastante extraño: el escalado. Tenemos un sistema de cierto tamaño de 1 y reducimos su tamaño paso a paso en pasos sucesivos de tomar la mitad de él y tirar la otra mitad. Digamos que el sistema tiene dos componentes, inicialmente n 1 moles del componente 1 y n 2 moles del componente 2. Estos números cambiarán a medida que el volumen del sistema,\(V\), cambie:
\[dn_1=n_1dV \nonumber \]
\[dn_2=n_2dV \nonumber \]
La energía libre de Gibbs es una variable extensa que se verá afectada de la misma manera:
\[dG = GdV \nonumber \]
En constante\(T\) y también\(P\) podemos escribir:
\[dG = \cancel{-SdT} + \cancel{VdP} + μ_1dn_1+μ_2dn_2 \nonumber \]
Entonces:
\[dG = μ_1dn_1+μ_2dn_2 \nonumber \]
\[GdV = μ_1n_1dV+μ_2n_2dV \nonumber \]
Si integramos esto desde el tamaño original, 1, hasta 0 (o 0 a 1, no importa). Obtenemos
\[ \int_0^1 GdV= \int_0^1 μ_1n_1dV+ \int_0^1 μ_2n_2dV \nonumber \]
\[G \int_0^1 dV= μ_1n_1 \int_0^1 dV+μ_2n_2 \int_0^1 dV \nonumber \]
\[G=μ_1n_1+μ_2n_2 \nonumber \]
Por el mismo argumento tenemos:
\[V=\bar{V}_{1}n_1+\bar{V}_{2}n_2 \nonumber \]
donde\(\bar{V}_i\) es el volumen molar parcial para el componente\(i\). Estos volúmenes molares parciales son generalmente una función de la composición (y\(P\),\(T\)) y han sido tabulados para una serie de sistemas líquidos. Nos permiten calcular el volumen real de una mezcla binaria. En términos generales, los volúmenes no son estrictamente aditivos. Este hecho suele ser ignorado en el análisis volumétrico y el uso de molaridades. Afortunadamente las desviaciones suelen ser insignificantes en las soluciones diluidas.
Para los diagramas de fases, la molaridad no es una cantidad muy adecuada para usar para la concentración debido a su dependencia de volumen (moles por litro). Por lo general, se trabaja con fracciones molares o molalidades (moles por kilogramo), donde no hay dependencias de volumen.
Mezclas Gaseosas
Los gases siempre se pueden mezclar en cualquier proporción y las mezclas suelen actuar cerca de lo ideal a menos que estén fuertemente comprimidas y/o llevadas a bajas temperaturas. La única excepción es si los gases reaccionan (por ejemplo, HCl y NH 3). Las moléculas de gas experimentan poca interacción entre sí y, por lo tanto, no importa mucho si las moléculas son diferencia o iguales. La presión total se puede calcular sumando las presiones parciales de los dos componentes:
\[P_{total} = P_1 + P_2 \label{PreDalton} \]
Mezclas Líquidas
Existen sistemas líquidos binarios que son totalmente miscibles y se dice que son soluciones ideales. No obstante, la situación es muy diferente en líquidos que en gases. Las moléculas líquidas suelen experimentar fuertes interacciones con sus vecinos. Para que la solución sea ideal, las interacciones deben permanecer igualmente fuertes incluso cuando el vecino es diferente. Esto significa que debe ser químicamente similar. Por esta razón, los binarios líquidos a menudo no son ideales. Lo siguiente más cercano son las soluciones regulares. Incluso estos sistemas pueden mostrar segregación de fase y solubilidades mutuas limitadas a bajas temperaturas. Muchos binarios líquido-líquido divergen de la idealidad incluso más que las soluciones regulares y muchos de ellos apenas son miscibles en absoluto.
| Solución/mezcla | Interacciones | Miscibilidad |
|---|---|---|
| Gas ideal | ninguno | completar |
| Líquido ideal | fuerte pero similar | completar |
| Líquido regular | fuerte, modestamente diferente | no siempre completa |
| Líquido real | a menudo muy disímiles | parcial o ninguno |
Mezclas Sólidas
Lo que dijimos sobre los binarios líquidos lo es aún más para los sólidos. La inmiscibilidad es la regla, la miscibilidad la excepción. Incluso los sistemas totalmente miscibles como el electrum (las aleaciones de plata y oro) ciertamente no son ideales.

Otro punto de importancia práctica (cinética más que termodinámica) es que aunque dos compuestos sean capaces de formar una solución sólida homogénea, generalmente se necesita calentamiento por periodos prolongados para conseguir que se mezclen porque la difusión de sólidos suele ser muy lenta. Sin embargo, la solubilidad en sólidos es un tema importante para muchos sistemas, particularmente para aleaciones metálicas. Dos sólidos moleculares, por ejemplo, compuestos orgánicos, de los cuales las moléculas difieren enormemente en forma, tamaño, polaridad y/o enlaces de hidrógeno tienen típicamente una solubilidad sólida mutua insignificante. Este último hecho es frecuentemente explotado en química orgánica para purificar compuestos mediante recristalización.
Las soluciones sólidas son relativamente poco frecuentes y nunca son ideales.
Diagramas ideales de fase líquida/gas ideal
Mezclemos dos líquidos juntos. Los líquidos suelen tener diferentes puntos de ebullición, siendo uno más volátil que el otro. La presión de vapor de un componente escala simplemente con la presión de vapor de equilibrio del componente puro. En fase gaseosa, la ley de Dalton es aplicable:
\[y_i= \dfrac{P_i}{P_{total}} \label{Dalton} \]
Esto es consecuencia de que los gases ideales no interactúan. Esto último implica que la presión total es simplemente la suma de las parciales:
\[P_{total} = \sum_i^N P_i \nonumber \]
Si la solución líquida es ideal, entonces la presión de vapor de ambos componentes sigue la ley de Raoult que dice que la presión de vapor de equilibrio por encima de la mezcla es la presión de equilibrio del componente puro multiplicada por la fracción molar:
\[P_i = x_iP^*_i \label{Raoult} \]
- \(P_i\)es la presión de vapor del componente\(i\) en la mezcla
- \(P^*_i\)es la presión de vapor de equilibrio del componente puro\(i\).
- \(x_i\)es la fracción molar de\(i^{th}\) componente en la fase líquida.
Los valores para los componentes puros se indican típicamente agregando un asterisco * superíndice.
La idea detrás de la ley de Raoult es que si las interacciones son similares, es cuestión de azar qué componente se asienta en la interfaz en un momento dado. La presión de vapor de equilibrio tiene que ver con la probabilidad de que una molécula despegue de la interfaz depende tanto de su volatilidad como de cuántas de ellas cubren la superficie\(P^*_i\) con la que tenemos que multiplicarnos\(x_i\).
La ley de Raoult rara vez se mantiene completamente, lo que es más aplicable si los dos componentes son casi químicamente idénticos como dos isómeros, por ejemplo, 1-propanol y 2-propanol.
El diagrama de fase de presión
Si asumimos que la temperatura es constante, podemos trazar la presión total para las leyes de Dalton y Raoult versus composición (de gas:\(y_1\) y líquido:\(x_1\) en el mismo eje).
Fase Líquida:
\[P_{total} = P_1 + P_2 = x_1P^*_1 +x_2P^*_2 = x_1P^*_1 +(1-x_1)P^*_2= P^*_2- x_1(P^*_2-P^*_1) \label{liquidus} \]
Claramente esta es una línea recta que va de\(P^*_2\) at\(x=0\) a\(P^*_1\) at\(x=1\).
Sin embargo, la composición del vapor en equilibrio con un líquido a una fracción molar dada\(x\) es diferente a la del líquido. Entonces no lo\(y\) es\(x\). Si tomamos la ley de Dalton (Ecuación\(\ref{Dalton}\)) y sustituimos la Ley de Raoult (Ecuación\(\ref{Raoult}\)) en el numerador y la recta en el denominador obtenemos:
\[y_1 = \dfrac{x_1P^*_1}{P^*_2- x_1(P^*_2-P^*_1)} \label{vaporus1} \]
Supongamos\(P^*_1 = 50\) Torr y\(P^*_2 = 25\) Torr. Si (X_1= 0.6\) ¿cuál es la composición del vapor?
Podemos reorganizar Ecuaciones\(\ref{liquidus}\) y\(\ref{vaporus1}\) trazar la presión total en función de\(y_1\):
\[P_{total}= \dfrac{P^*_1P^*_2 }{P^*_1 + (P^*_2-P^*_1)y_1} \label{vaporus2} \]
Esto no es una línea recta.
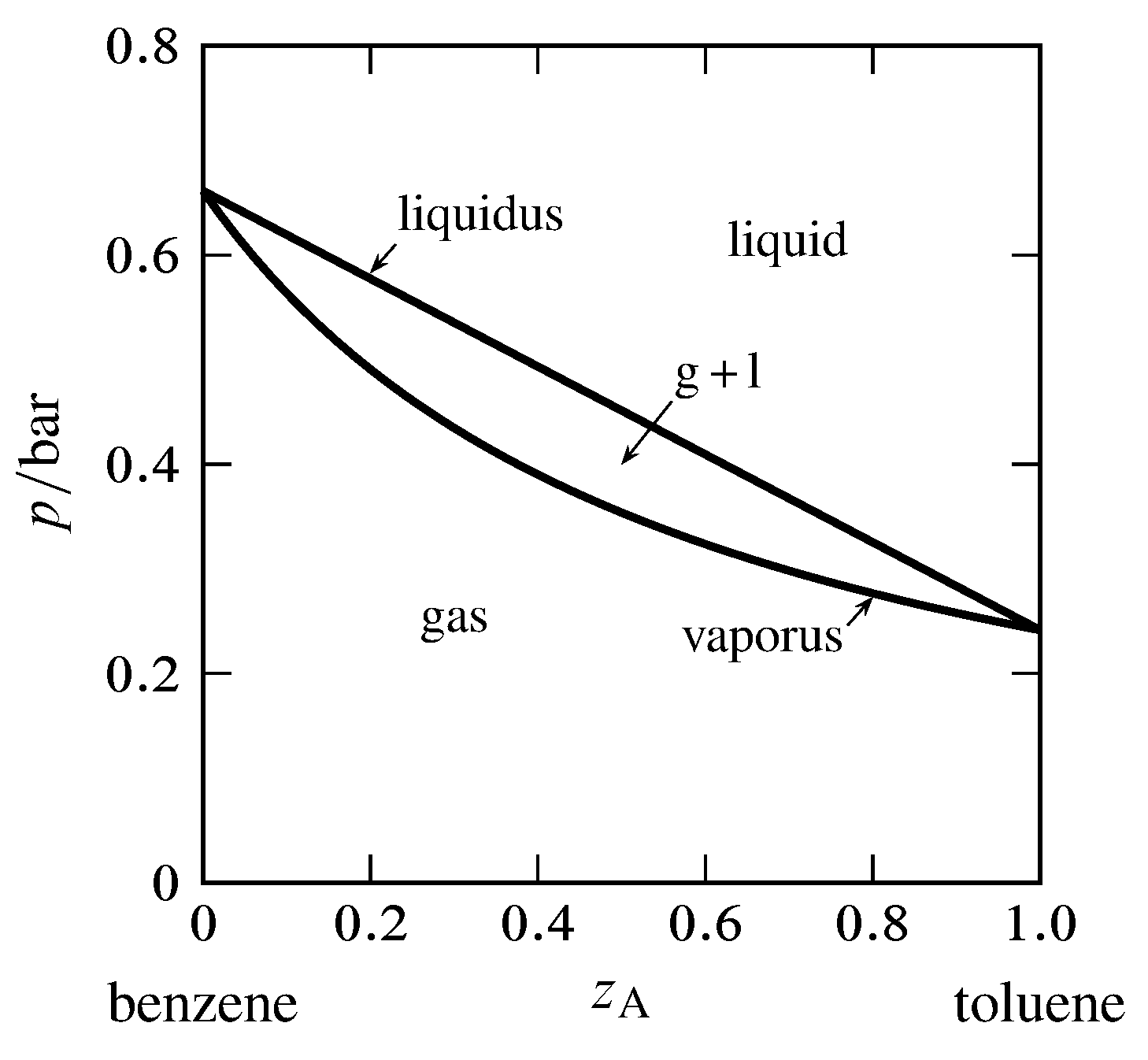
Como puedes ver cuando trazamos ambas líneas obtenemos un diagrama con tres regiones. A altas presiones solo tenemos un líquido. A bajas presiones solo tenemos un gas. En el medio tenemos una brecha de fase o región de dos fases. Los puntos dentro de esta región representan estados que el sistema no puede lograr de manera homogénea. La línea de unión horizontal muestra qué dos fases coexisten. Usé los mismos valores de 25 y 50 Torr para las presiones de equilibrio puro que en la pregunta anterior. Si intentas hacer un sistema con composición total x e imponer una presión que cae en la zona prohibida obtienes dos fases: una gaseosa que es más rica en el componente más volátil y otra líquida que es más pobre en el componente volátil de lo que indicaría la composición general.
El diagrama de fases de temperatura
Tenga en cuenta que la pregunta: ¿qué fase tenemos cuando? es realmente una función de ambos\(P\) y\(T\), de manera que si queremos representar todo nuestro conocimiento en un diagrama debemos convertirlo en una imagen tridimensional. Esto no es tan fácil de dibujar y tampoco es fácil de comprender visualmente. Es por ello que solemos observar una sección transversal 2D del espacio 3D.
El diagrama anterior es isotérmico: variamos\(P\), manteniéndonos\(T\) constantes. Sin embargo, es más habitual (y más fácil) hacerlo al revés. Mantenemos la presión constante (digamos 1 bar, eso es fácil) y comenzamos a calentar las cosas isobáricamente.
Los puntos de ebullición de nuestras mezclas también se pueden trazar contra\(x\) (la composición líquida) y\(y\) (la gaseosa) en el mismo eje horizontal. Nuevamente porque en general no\(y\) es igual\(x\) obtenemos dos curvas distintas. Ninguno de ellos son líneas rectas en este caso y terminamos con una región bifásica en forma de lente:

Lo que sucede con una mezcla con una composición total dada x (=x 1) cuando se lleva a una temperatura donde hierve se puede ver en la intersección de una línea vertical (una isópleta) en\(x_{overall}\) y una horizontal (una isoterma) en\(T_{boil}\). Si la intersección apunta dentro de la región de dos fases, se obtiene una fase de vapor y una fase líquida que tienen una composición diferente a la general. La fase vapor siempre es más rica en el componente más volátil (el que tiene el punto de ebullición más bajo, a la izquierda en el diagrama). La fase líquida se enriquece en la menos volátil.
La regla de la palanca
La cantidad de cada fase que está presente está representada por las flechas en el diagrama. La cantidad de líquido es proporcional a la flecha izquierda, la cantidad de gas a la derecha (es decir, funciona transversalmente). La composición del líquido en equilibrio con el vapor es:
\[x_2 = \dfrac{n^{liq}_2}{n^{liq}_{1+2}} \nonumber \]
\[x_2^*n^{liq}_{1+2} = n^{liq}_2 \nonumber \]
La composición del vapor es:
\[y_2 = \dfrac{n^{gas}_2}{n^{gas}_{1+2}} \nonumber \]
\[y_2^*n^{gas}_{1+2} = n^{gas}_2 \nonumber \]
La composición general es:
\[x_{all} = \dfrac{n^{liq+gas}_2 }{n^{liq+gas}_{1+2}} \nonumber \]
\[x_{all}^*n^{liq+gas}_{1+2} = n^{gas}_2+n^{liq}_2 \nonumber \]
\[x_{all}^*n^{liq+gas}_{1+2} = y_2^*n^{gas}_{1+2}+x_2^*n^{liq}_{1+2} \nonumber \]
\[x_{all}^*n^{gas}_{1+2}+x_{all}^*n^{liq}_{1+2} = y_2^*n^{gas}_{1+2}+x_2^*n^{liq}_{1+2} \nonumber \]
Así:
\[ \dfrac{n^{liq}_{1+2} }{n^{gas}_{1+2}} = \dfrac{y_2-x_{all}}{ x_{all}-x_2} \nonumber \]
Destilación
La diferencia de composición entre el gas y el líquido se puede explotar para separar los dos componentes, al menos parcialmente. Podríamos atrapar el vapor y enfriarlo para formar un líquido con una composición diferente. Entonces podríamos hervirlo de nuevo y repetir el proceso. Cada vez el vapor estará más enriquecido en la fase volátil mientras que el líquido residual se enriquecerá más en la menos volátil. Este proceso se conoce como destilación. En la práctica el proceso se realiza una columna de fraccionamiento que permite tener una serie de equilibrios vapor-líquido a la vez.
De esta manera se puede alcanzar un buen grado de pureza, aunque el 100% de pureza tomaría un número infinito de etapas de destilación.

