26.1: Resultados de equilibrio cuando se minimiza la energía de Gibbs
- Page ID
- 79550
Muchas reacciones químicas importantes -si no la mayoría - se realizan en solución y no entre sólidos o gases. Las reacciones en estado sólido suelen ser muy lentas y no todas las especies químicas pueden ponerse en fase vapor porque se descomponen antes de evaporarse.
Muchas veces no nos preocupan los aspectos temporales de una reacción. Eso puede ser tecnológicamente muy importante pero es el dominio de la cinética -una rama diferente de la Química Física- en lugar de la termodinámica clásica.. Este último está más preocupado por el punto final. Este es el equilibrio termodinámicamente hablando (estable), pero químicamente puede representar una reacción completa o un equilibrio químico.
Desafortunadamente, de los tres estados principales de agregación: gas — líquido — sólido, la estructura de los líquidos es menos entendida y uno de los líquidos más complejos es también uno de los más utilizados: el agua. Es vital para muchas ramas de la química que van desde la geoquímica hasta la química ambiental y la bioquímica. Haremos sólo una pequeña incursión en su complejidad.
Grado de reacción
Para describir el progreso de una reacción definimos el alcance de la reacción. Por lo general se denota con la letra griega\(ξ\).
Considera una reacción genérica:
\[v_AA + v_BB \rightleftharpoons v_YY + v_ZZ \nonumber \]
Usando estequiometría podemos definir la extensión considerando cómo cambia el número de moles (o cantidades molares) de cada especie durante la reacción:
reactantes
- \(n_A= n_{A,0} - v_A ξ\)
- \(n_B= n_{B,0} - v_B ξ\)
productos
- \(n_Y= n_{Y,0} + v_Y ξ\)
- \(n_Z= n_{Z,0} + v_Z ξ\)
La dimensión de es [mol] porque los coeficientes estequiométricos v i son enteros adimensionales. Si la reacción va a completarse para uno de los reactivos -el reactivo limitante -n A o B =n limitante irá a cero. Si comenzamos con\(n_{limiting}= v_{limiting}\) moles, el valor de comienza en 0 (sin productos) y va a 1 al finalizar (limitando el reactivo agotado). Al acercarse a un equilibrio no\(ξ\) irá más allá\(ξ_{eq}\).
Medir
El grado de reacción es lo que es el tema central de la cinética de reacción. Su valor se mide típicamente como una función del tiempo indirectamente midiendo una cantidad q que es linealmente dependiente de (t):
\[q( ξ ) = aξ +b \nonumber \]
Considerar la situación en los extremos\(ξ=0\) y\(ξ=1\):
\[q_0= a.0+b= b \nonumber \]
\[q_1= a.1+b= a+b \nonumber \]
\[q_1-q_0= a \nonumber \]
Por lo tanto, se\(ξ\) puede encontrar en
\[\dfrac{q(t)-q0}{q_1-q_0}=\dfrac{q(t)-b}{a} \nonumber \]
La naturaleza de\(q\) puede variar ampliamente desde la absorción UV/Vis, conductividad, gravimétrica a datos calóricos.
En la práctica,\(q_0\) at\(ξ=0\) suele ser difícil de observar porque lleva tiempo mezclar los reactivos, particularmente en soluciones, y q 1 a =1 puede que nunca se alcance si la reacción va al equilibrio. Sin embargo, los valores de a y b a menudo se pueden encontrar a partir de los datos disponibles mediante técnicas de ajuste.
En termodinámica (equilibrio, estática) solo nos preocupa el punto final:
- \(ξ=1\): la reacción transcurre hasta su finalización
- \(ξ=ξ_{eq}\): el ion de reacción pasa a un estado de equilibrio químico
Potenciales termodinámicos
Como hemos visto podemos escribir cualquier cambio en la energía libre de Gibbs debido a cambios en las cantidades molares de las especies involucradas en la reacción (at\(T\),\(P\) constante) como:
\[dG =\sum \dfrac{∂G}{∂n_i} dn_i = \sum μ_idn_i \nonumber \]
donde\(μ\) está el potencial termodinámico, a menudo llamado potencial químico cuando se trata de reacciones. De la definición de podemos ver por diferenciación que
- \(d n_A=- v_Adξ\)
- \(d n_B=- v_Adξ\)
- \(d n_Y= v_Ydξ\)
- \(d n_Z= v_Zdξ\)
Esto nos permite unificar los cambios en la cantidad molar de todas las especies en una sola variable\(dξ\). Obtenemos:
\[dG = \left[ \sum -v_{i,reactants} μ_{i,reactants} + \sum+v_{i,products} μ_{j,products} \right]dξ \nonumber \]
o
\[ \left (\dfrac{∂G}{∂ξ} \right)_{T,P} = -\sum v_{i,r}μ_{i,r}+ \sum v_{i,p}μ_{j,p} \nonumber \]
Esta cantidad también se escribe como:
\[ \left( \dfrac{∂G}{∂ξ} \right)_{T,P} =Δ_rG \nonumber \]
Esta cantidad le da al cambio en Gibbs energía libre para la reacción (¡como está escrito!!) para Δ=1 mol. (Las unidades son [J/mol] por lo tanto). Este es el cambio en la energía de Gibbs (la pendiente de\(G\) vs\(\xi\)) cuando la extensión de la reacción cambia en un mol con una composición fija. El equilibrio resulta cuando la energía de Gibbs está en un mínimo con respecto al alcance de la reacción.
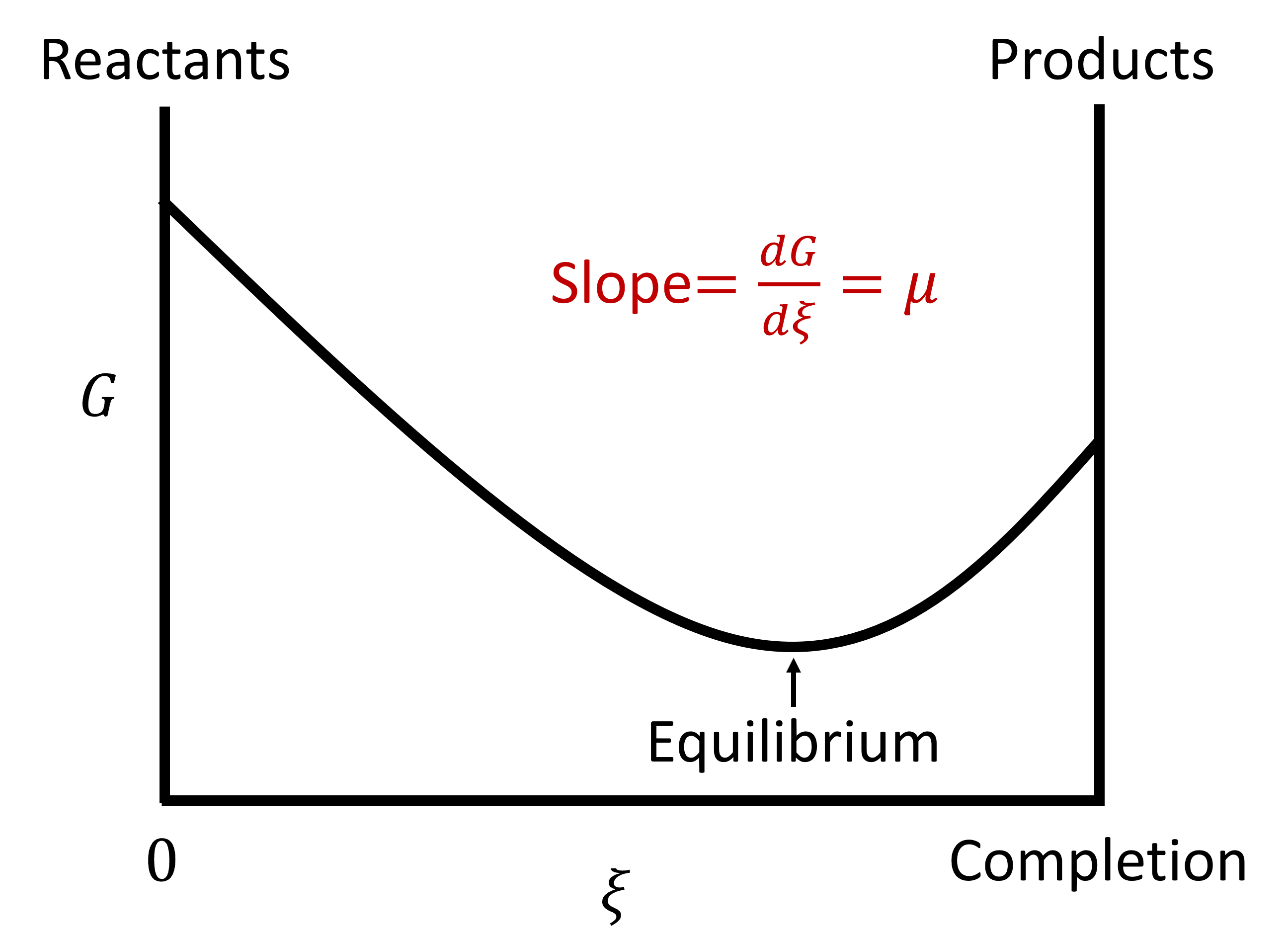
Reacciones de gas
Supongamos que nuestra reacción es enteramente entre especies de gas y que el gas está suficientemente diluido como para que podamos usar la ley de gas ideal. Entonces podemos escribir para cada especie:
\[μ_i= μ_i^o+RT \ln \dfrac{P_i}{P_i^o} \nonumber \]
Luego podemos dividir la expresión Δ r G en dos partes:
\[Δ_rG = Δ_rG^o + RT\ln Q \nonumber \]
Los potenciales estándar:
\[Δ_rG^o = -\sum v_i,_r μ^o_{i,r} + \sum v_{i,p} μ^o_{j,p} \nonumber \]
y los términos logarítmicos:
\[RT \ln Q= - v_A RT \ln \left( \dfrac{P_A}{P_A^o} \right)- v_B RT\ln \left( \dfrac{P_B}{P_B^o} \right) + v_YRT \ln \left( \dfrac{P_Y}{P_Y^o} \right) + v_ZRT \ln \left( \dfrac{P_Z}{P_Z^o} \right) \nonumber \]
Podemos combinar todos los términos logarítmicos en Q, llamado cociente de reacción. Los coeficientes estequiométricos se convierten en exponentes y los factores de los reactivos estarán “al revés” en comparación con los productos, debido a las propiedades de los logaritmos:
\[a \ln x = \ln x^a \nonumber \]
\[- a \ln x = \ln \left( \dfrac{1}{x^a} \right) \nonumber \]
Hemos mantenido las presiones estándar\(P_i^o\) en la expresión, pero muchas veces se omiten. Suelen ser todas de 1 bar, pero en principio podríamos elegir 1 bar para A 1 Torr por B y 1 psi para los productos. Crea una definición válida (aunque ridícula) de lo que significa o. (¡Claro que el valor de\(Δ_rG^o\) sí depende de esa elección!).
Podríamos escribir
\[RT \ln Q = RT \ln \dfrac{Q_P}{Q^o} \nonumber \]
\(Q^o\)es típicamente unidad en magnitud pero cancela las dimensiones de\(Q_P\). Eso significa que\(Q\) y\(Q_P\) son iguales en magnitud y podemos obtener\(Q\) de simplemente\(Q_P\) dejando caer las dimensiones. \(Q\)es adimensional pero\(Q_P\) por lo general no lo es. A menudo esta fina distinción simplemente no se hace y\(Q^o\) se omite, obtenemos:
\[Δ_rG = Δ_rG^o + RT\ln \dfrac{P_Y^{v_Y}P_Z^{v_Z} }{P_A^{v_A}P_B^{v_B}} \nonumber \]
Observe la diferencia entre las\(Δ_rG\) cuales denota las condiciones (e.g., presiones) de su reacción y\(Δ_rG^o\) denota condiciones estándar.

