31.10: La reacción Haber-Bosch puede ser catalizada en superficie
- Page ID
- 80001
El Proceso Haber-Bosch para la Síntesis de Amoníaco
Un ejemplo de un proceso catalítico industrial es el proceso Haber-Bosch. Karl Bosch (1874—1940) fue un ingeniero químico alemán que se encargó de diseñar el proceso que aprovechó los descubrimientos de Fritz Haber con respecto al equilibrio N 2 + H 2/NH 3 para hacer rentable la síntesis de amoníaco a través de esta ruta. Recibió el Premio Nobel de Química en 1931 por su trabajo. El proceso industrial se llama ya sea el proceso Haber o el proceso Haber-Bosch. Se utiliza para sintetizar amoníaco a través de la siguiente reacción:
\[N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)} \nonumber \]
con
\[ΔH_{rxn}=−91.8\; kJ/mol \nonumber \]
Debido a que la reacción convierte 4 mol de reactivos gaseosos en solo 2 moles de producto gaseoso, el principio de Le Chatelier predice que la formación de NH 3 se verá favorecida cuando se incremente la presión. La reacción es exotérmica, sin embargo (Δ H rxn = −91.8 kJ/mol), por lo que la constante de equilibrio disminuye con el aumento de la temperatura, lo que provoca que una mezcla de equilibrio contenga solo cantidades relativamente pequeñas de amoníaco a altas temperaturas (\(\PageIndex{1}\)). En conjunto, estas consideraciones sugieren que el rendimiento máximo de NH 3 se obtendrá si la reacción se lleva a cabo a una temperatura y una presión lo más bajas posible. Desafortunadamente, a temperaturas inferiores a aproximadamente 300°C, donde el rendimiento de equilibrio del amoníaco sería relativamente alto, la reacción es demasiado lenta para ser de cualquier uso comercial. El proceso industrial, por lo tanto, utiliza un catalizador de óxido mixto (Fe 2 O 3 /K 2 O) que permite que la reacción proceda a una velocidad significativa a temperaturas de 400°C—530°C, donde la formación de amoníaco es menos desfavorable que a temperaturas más altas.
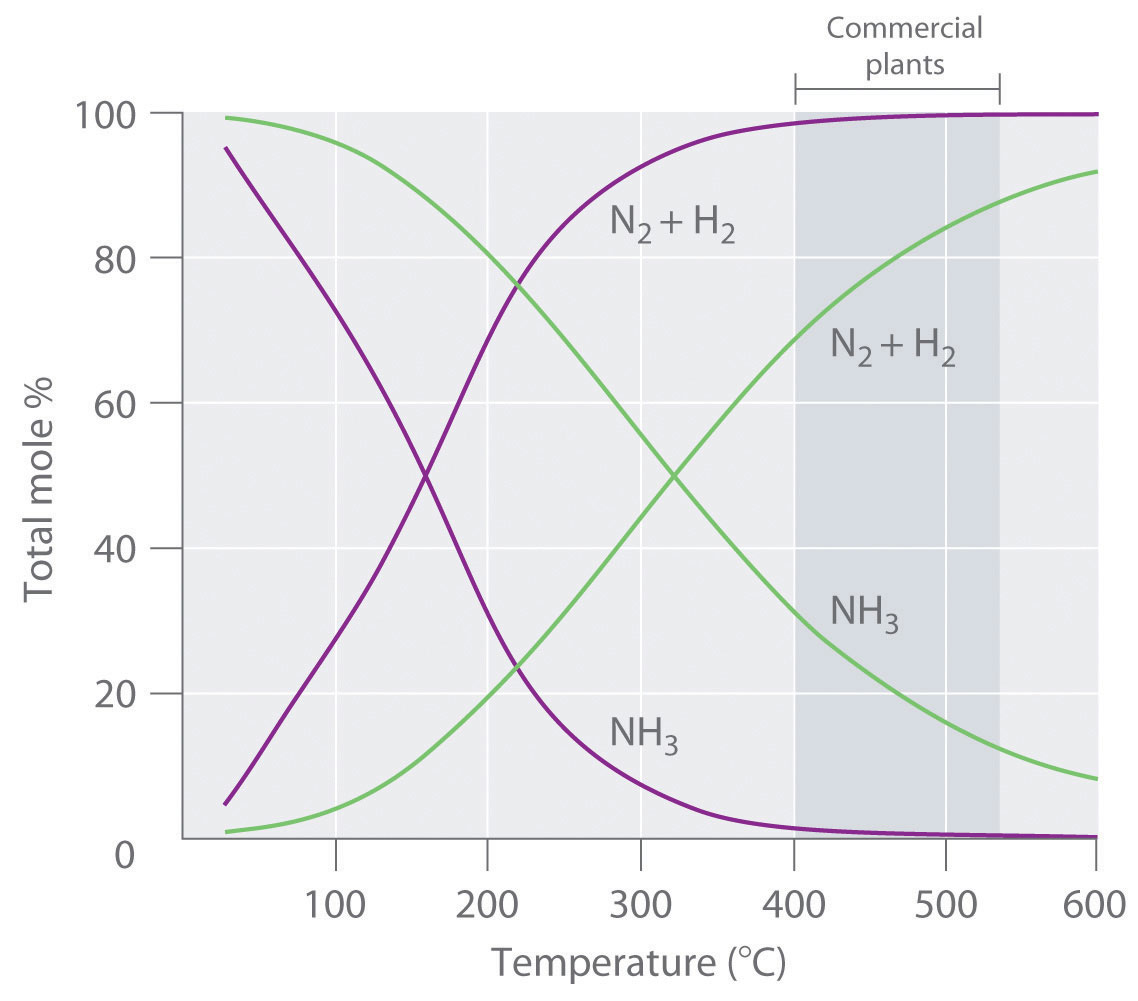
Figura\(\PageIndex{1}\) Efecto de la Temperatura y Presión sobre la Composición de Equilibrio de Dos Sistemas que Originalmente Contuvieron una Mezcla 3:1 de Hidrógeno y Nitrógeno: A todas las temperaturas, la presión total en los sistemas fue inicialmente de 4 atm (curvas moradas) o 200 atm (curvas verdes). Obsérvese la dramática disminución en la proporción de NH 3 en equilibrio a temperaturas más altas en ambos casos, así como el gran aumento en la proporción de NH 3 en equilibrio a cualquier temperatura para el sistema a mayor presión (verde) versus menor presión (púrpura). Las plantas comerciales que utilizan el proceso Haber-Bosch para sintetizar amoníaco a escala industrial operan a temperaturas de 400°C—530°C (indicadas por la banda gris más oscura) y presiones totales de 130—330 atm.
Debido al bajo valor de la constante de equilibrio a altas temperaturas (e.g., K = 0.039 a 800 K), no hay manera de producir una mezcla de equilibrio que contenga grandes proporciones de amoníaco a altas temperaturas. Sin embargo, podemos controlar la temperatura y la presión mientras se usa un catalizador para convertir una fracción del N 2 y H 2 en la mezcla de reacción a NH 3, como se hace en el proceso Haber-Bosch. Este proceso también hace uso del hecho de que el producto —el amoníaco— es menos volátil que los reactivos. Debido a que NH 3 es un líquido a temperatura ambiente a presiones mayores a 10 atm, el enfriamiento de la mezcla de reacción hace que NH 3 se condense del vapor como amoníaco líquido, el cual se separa fácilmente de N 2 y H 2 sin reaccionar. Los gases sin reaccionar se reciclan hasta que finalmente se logra la conversión completa de hidrógeno y nitrógeno en amoníaco. La figura\(\PageIndex{2}\) es un diseño simplificado de una planta de proceso Haber-Bosch.
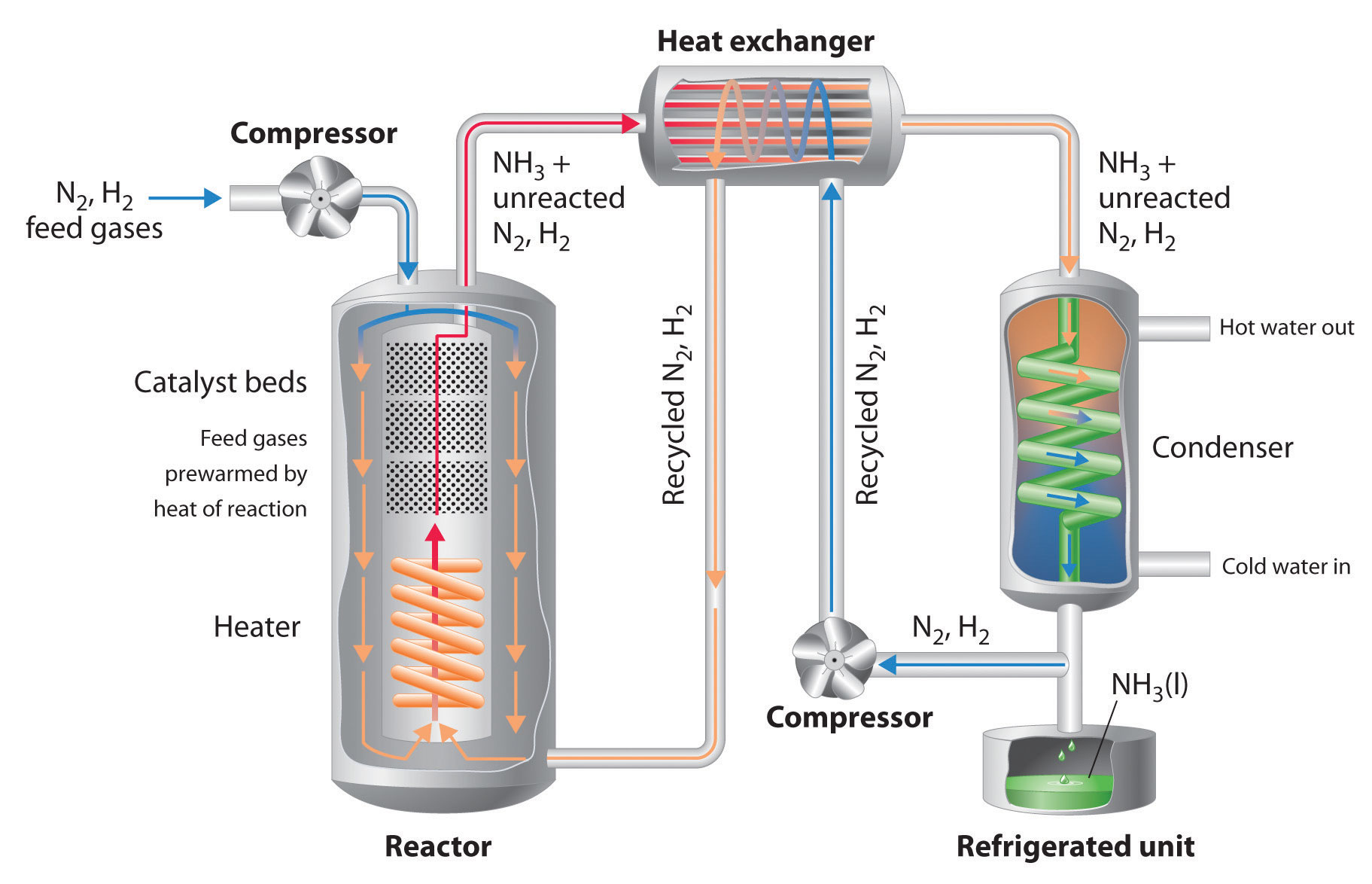
Figura\(\PageIndex{2}\) A Diagrama esquemático de una planta industrial para la producción de amoníaco mediante el proceso Haber-Bosch: Una mezcla 3:1 de H 2 y N2 gaseosos se comprime a 130—330 atm, se calienta a 400°C-530°C, y se pasa sobre un Fe 2 O 3/K Catalizador de 2 O, lo que resulta en la conversión parcial a NH 3 gaseoso. La mezcla resultante de NH 3, H 2 y N 2 gaseosos se hace pasar a través de un intercambiador de calor, que utiliza los gases calientes para precalentar N 2 y H 2 reciclados, y un condensador para enfriar el NH 3, dando un líquido que se separa fácilmente de N 2 y H 2 sin reaccionar. (Aunque el punto de ebullición normal de NH 3 es −33°C, el punto de ebullición aumenta rápidamente con el aumento de la presión, a 20°C a 8.5 atm y 126°C a 100 atm.) Los N 2 y H 2 sin reaccionar se reciclan para formar más NH 3.
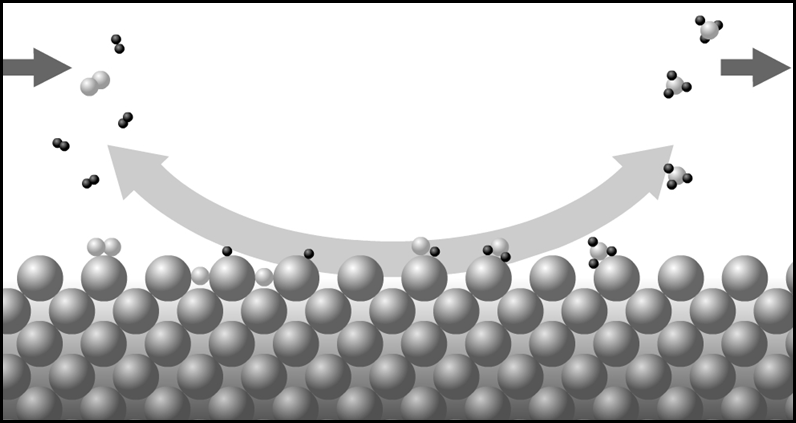
Podemos escribir las siete reacciones que están involucradas en el proceso donde ad indica que la molécula o átomo está adsorbido sobre el catalizador
\[ H_{2}(g) + 2 S(s) \rightleftharpoons 2H \mathit{(ad)} \label{1} \]
\[ N_{2}(g) \rightleftharpoons N_2 \mathit{(ad)} \label{2} \]
\[ N_2 \mathit{(ad)} + 2 S(s) \rightleftharpoons 2N \mathit{(ad)} \label{3} \]
\[ H \mathit{(ad)} + N \mathit{(ad)} \rightleftharpoons NH \mathit{(ad)} \label{4} \]
\[ NH \mathit{(ad)} + H \mathit{(ad)} \rightleftharpoons NH_2 \mathit{(ad)} \label{5} \]
\[ NH_2 \mathit{(ad)} + H \mathit{(ad)} \rightleftharpoons NH_3 \mathit{(ad)} \label{6} \]
\[ NH_3 \mathit{(ad)} \rightleftharpoons NH_{3}(g) \label{7} \]
La reacción\(\ref{3}\) es mucho la más lenta, y por lo tanto el paso determinante de la velocidad. La figura\(\PageIndex{3}\) resume el esquema de reacción.
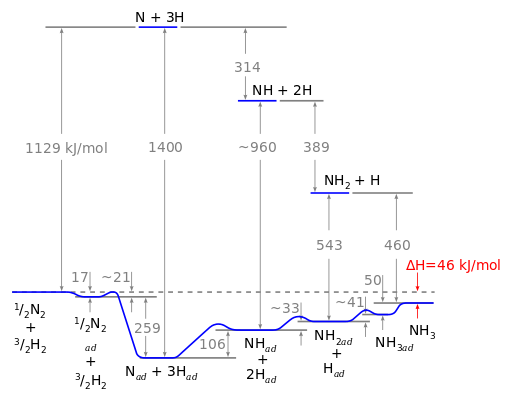
Gerhard Ertl trabajó la energía de la reacción mostrada en la Figura\(\PageIndex{4}\) siguiente muestra la cantidad de energía por mol necesaria en el catalizador y la que sería necesaria en la fase gaseosa. El discurso del Premio Nobel de Ertl sobre su trabajo sobre las reacciones catalíticas que forman amoníaco y otras reacciones catalíticas se puede ver en línea.
Estudios adicionales del catalizador Fe 2 O 3/K 2 O han demostrado que la velocidad de la reacción depende de la superficie particular sobre la que se está produciendo la reacción. La figura\(\PageIndex{5}\) muestra las velocidades de reacción para la síntesis de amoníaco en cinco superficies diferentes del hierro.
Colaboradores
- Anonymous
Modified by Joshua Halpern (Howard University), Scott Sinex, and Scott Johnson (PGCC)
La cifra\(\PageIndex{3}\) es de la ESA, ahora disponible en la máquina wayback de Internet
La figura\(\PageIndex{4}\) es de Wikipedia Commons

