13.1: Ciclo Carnot
- Page ID
- 75327
A principios del siglo XIX, las máquinas de vapor llegaron a desempeñar un papel cada vez más importante en la industria y el transporte. Sin embargo, aún no se había desarrollado un conjunto sistemático de teorías sobre la conversión de la energía térmica en potencia motriz por las máquinas de vapor. Nicolas Léonard Sadi Carnot (1796-1832), ingeniero militar francés, publicó Reflexiones sobre el poder motriz del fuego en 1824. El libro propuso una teoría generalizada de los motores térmicos, así como un modelo idealizado de un sistema termodinámico para un motor térmico que ahora se conoce como el ciclo Carnot. Carnot desarrolló la base de la segunda ley de la termodinámica, y a menudo se le describe como el “Padre de la termodinámica”.
El ciclo del carnot
El ciclo Carnot consta de los siguientes cuatro procesos:
- Un proceso de expansión de gas isotérmico reversible. En este proceso, el gas ideal en el sistema absorbe la\(q_{in}\) cantidad de calor de una fuente de calor a alta temperatura\(T_{high}\), se expande y funciona en los alrededores.
- Un proceso de expansión de gas adiabático reversible. En este proceso, el sistema está aislado térmicamente. El gas continúa expandiéndose y trabajando en los alrededores, lo que hace que el sistema se enfríe a una temperatura más baja,\(T_{low}\).
- Un proceso de compresión de gas isotérmico reversible. En este proceso, los alrededores hacen trabajo al gas en\(T_{low}\), y provoca una pérdida de calor,\(q_{out}\).
- Un proceso de compresión adiabática reversible de gas. En este proceso, el sistema está aislado térmicamente. Alrededores continúan haciendo trabajo al gas, lo que hace que la temperatura vuelva a subir a\(T_{high}\).
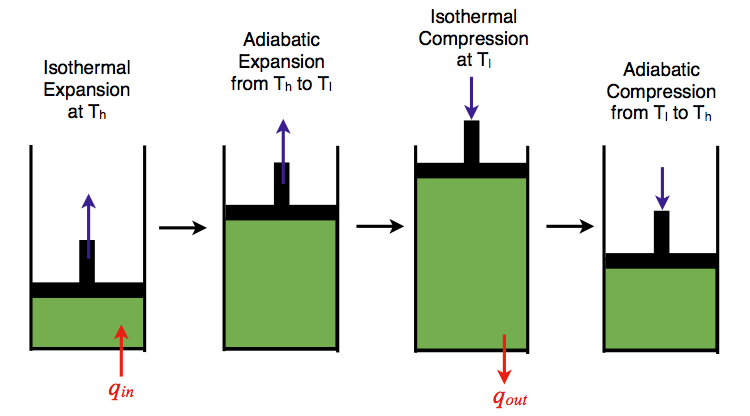
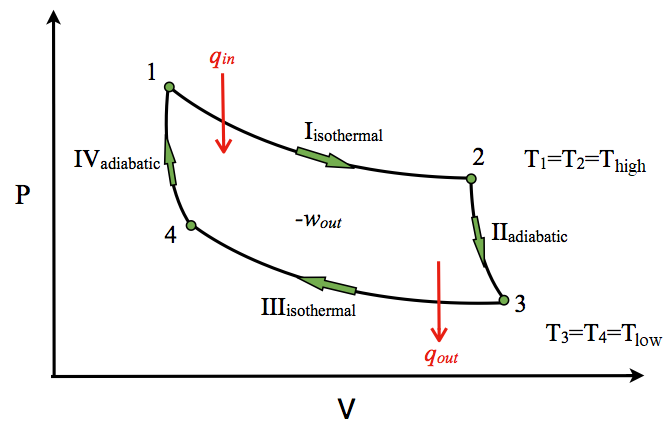
Diagrama P-V
El diagrama P-V del ciclo Carnot se muestra en la Figura\(\PageIndex{2}\). En los procesos isotérmicos I y III, ∆U=0 porque ∆T=0. En los procesos adiabáticos II y IV, q=0. El trabajo, el calor, ∆U y ∆H de cada proceso en el ciclo de Carnot se resumen en la Tabla\(\PageIndex{1}\).
| Proceso | w | q | ΔU | ΔH |
|---|---|---|---|---|
| I | \(-nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)\) | \(nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)\) | 0 | 0 |
| II | \(n\bar{C_{v}}(T_{low}-T_{high})\) | 0 | \(n\bar{C_{v}}(T_{low}-T_{high})\) | \(n\bar{C_{p}}(T_{low}-T_{high})\) |
| III | \(-nRT_{low}\ln\left(\dfrac{V_{4}}{V_{3}}\right)\) | \(nRT_{low}\ln\left(\dfrac{V_{4}}{V_{3}}\right)\) | 0 | 0 |
| IV | \(n\bar{C_{v}}(T_{high}-T_{low})\) | 0 | \(n\bar{C_{v}}(T_{hight}-T_{low})\) | \(n\bar{C_{p}}(T_{high}-T_{low})\) |
| Ciclo completo | \(-nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)-nRT_{low}\ln\left(\dfrac{V_{4}}{V_{3}}\right)\) | \(nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)+nRT_{low}\ln\left(\dfrac{V_{4}}{V_{3}}\right)\) | 0 | 0 |
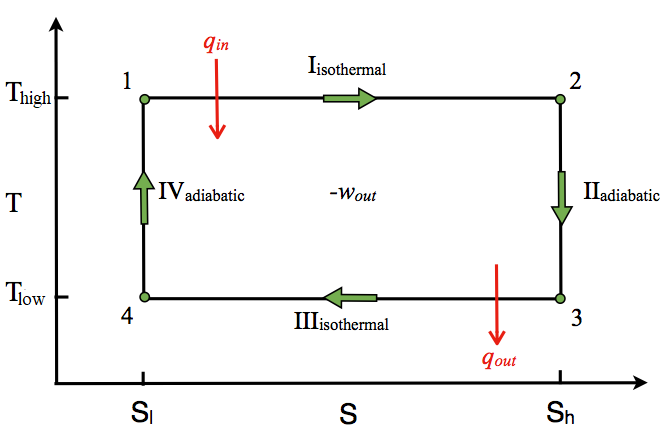
Diagrama T-S
El diagrama T-S del ciclo Carnot se muestra en la Figura\(\PageIndex{3}\). En los procesos isotérmicos I y III, ∆T=0. En los procesos adiabáticos II y IV, ∆S=0 porque dq=0. ∆T y ∆S de cada proceso en el ciclo Carnot se muestran en la Tabla\(\PageIndex{2}\).
| Proceso | ΔT | ΔS |
|---|---|---|
| I | 0 | \(-nR\ln\left(\dfrac{V_{2}}{V_{1}}\right)\) |
| II | \(T_{low}-T_{high}\) | 0 |
| III | 0 | \(-nR\ln\left(\dfrac{V_{4}}{V_{3}}\right)\) |
| IV | \(T_{high}-T_{low}\) | 0 |
| Ciclo completo | 0 | 0 |
Eficiencia
El ciclo Carnot es el motor más eficiente posible basado en el supuesto de la ausencia de procesos incidentales de desperdicio como la fricción, y la suposición de que no hay conducción de calor entre diferentes partes del motor a diferentes temperaturas. La eficiencia del motor carnot se define como la relación entre la salida de energía y la entrada de energía.
\[\begin{align*} \text{efficiency} &=\dfrac{\text{net work done by heat engine}}{\text{heat absorbed by heat engine}} =\dfrac{-w_{sys}}{q_{high}} \\[4pt] &=\dfrac{nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)+nRT_{low}\ln \left(\dfrac{V_{4}}{V_{3}}\right)}{nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)} \end{align*}\]
Dado que los procesos II (2-3) y IV (4-1) son adiabáticos,
\[\left(\dfrac{T_{2}}{T_{3}}\right)^{C_{V}/R}=\dfrac{V_{3}}{V_{2}}\]
y
\[\left(\dfrac{T_{1}}{T_{4}}\right)^{C_{V}/R}=\dfrac{V_{4}}{V_{1}}\]
Y como T 1 = T 2 y T 3 = T 4,
\[\dfrac{V_{3}}{V_{4}}=\dfrac{V_{2}}{V_{1}}\]
Por lo tanto,
\[\text{efficiency}=\dfrac{nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)-nRT_{low}\ln\left(\dfrac{V_{2}}{V_{1}}\right)}{nRT_{high}\ln\left(\dfrac{V_{2}}{V_{1}}\right)}\]
\[\boxed{\text{efficiency}=\dfrac{T_{high}-T_{low}}{T_{high}}}\]
Resumen
El ciclo Carnot tiene la mayor eficiencia posible de un motor (aunque otros ciclos tienen la misma eficiencia) basado en el supuesto de la ausencia de procesos incidentales de desperdicio como la fricción, y la suposición de no conducción de calor entre diferentes partes del motor a diferentes temperaturas.
Problemas
- Ahora está operando un motor Carnot al 40% de eficiencia, que agota el calor a un disipador de calor a 298 K. Si desea aumentar la eficiencia del motor a 65%, ¿a qué temperatura tendría que elevar el depósito de calor?
- Un motor Carnot absorbió 1.0 kJ de calor a 300 K y agotó 400 J de calor al final del ciclo. ¿Cuál es la temperatura al final del ciclo?
- Un calentador interior que opera en el ciclo Carnot está calentando la casa a una velocidad de 30 kJ/s para mantener la temperatura interior a 72 ºF. ¿Cuál es la potencia que opera el calentador si la temperatura exterior es de 30 ºF?
Referencias
- Goldstein, M. J. Chem. Educ. , 1980, 57, 114-116
- Bader, M. J. Chem. Educ. , 1973, 50, 834
- W. F. Luder. J. Chem. Educ. , 1944, 21, 600-601
- Salter, C. J. Chem. Educ. , 2000, 77, 1027-1030

