22.1: Fundamentos de Transiciones de Fase
- Page ID
- 75196
La transición de fase es cuando una sustancia cambia de un estado sólido, líquido o gaseoso a un estado diferente. Cada elemento y sustancia puede pasar de una fase a otra a una combinación específica de temperatura y presión.
Cambios de fase
Cada sustancia tiene tres fases en las que puede cambiar; sólida, líquida o gaseosa (1). Cada sustancia se encuentra en una de estas tres fases a ciertas temperaturas. La temperatura y presión a la que cambiará la sustancia es muy dependiente de las fuerzas intermoleculares que están actuando sobre las moléculas y átomos de la sustancia (2). Puede haber dos fases coexistiendo en un solo contenedor al mismo tiempo. Esto suele ocurrir cuando la sustancia está en transición de una fase a otra. Esto se denomina estado bifásico (4). En el ejemplo del derretimiento del hielo, mientras el hielo se está derritiendo, hay agua sólida y agua líquida en la copa.
Hay seis formas en que una sustancia puede cambiar entre estas tres fases; fundiendo, congelando, evaporando, condensando, subliminando y depositando (2). Estos procesos son reversibles y cada uno se transfiere entre fases de manera diferente:
- Fusión: La transición de la fase sólida a la líquida
- Congelación: La transición de la fase líquida a la fase sólida
- Evaporación: La transición de la fase líquida a la fase gaseosa
- Condensación: La transición de la fase gaseosa a la fase líquida
- Subliminación: La transición de la fase sólida a la fase gaseosa
- Deposición: La transición de la fase gaseosa a la fase sólida
Cómo funciona la transición de fase
Hay dos variables a considerar al observar la transición de fase, presión (P) y temperatura (T). Para el estado gaseoso, La relación entre temperatura y presión se define por las siguientes ecuaciones:
Ley de Gas Ideal:
\[ PV=nRT\]
van der Waals Ecuación de Estado:
\[ \left(P+a*\frac{n^2}{V^2}\right)\left(V-nb\right)=nRT\]
Donde V es volumen, R es la constante de gas, y n es el número de moles de gas.
La ley del gas ideal supone que ninguna fuerza intermolecular está afectando al gas de ninguna manera, mientras que la ecuación de van der Waals incluye dos constantes, a y b, que dan cuenta de cualquier fuerza intermolecular que actúe sobre las moléculas del gas.
Temperatura
La temperatura puede cambiar la fase de una sustancia. Un ejemplo común es poner agua en un congelador para convertirlo en hielo. En la imagen de arriba, tenemos una sustancia sólida en un recipiente. Cuando lo ponemos en una fuente de calor, como un quemador, el calor se transfiere a la sustancia aumentando la energía cinética de las moléculas en la sustancia. La temperatura aumenta hasta que la sustancia alcanza su punto de fusión (2). A medida que más y más calor se transfiere más allá del punto de fusión, la sustancia comienza a fundirse y convertirse en un líquido (3). Este tipo de cambio de fase se denomina proceso isobárico porque la presión del sistema se mantiene en un nivel constante.
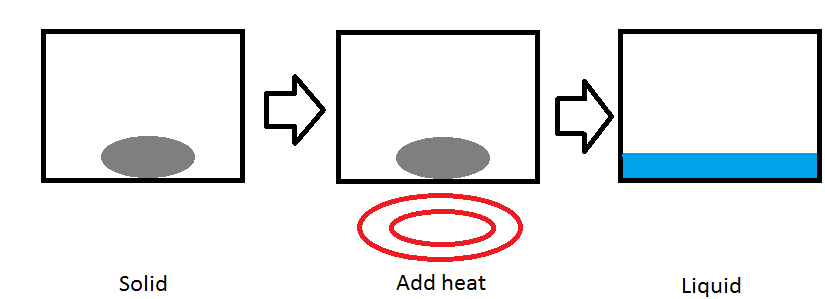
Punto de fusión (T f)
Cada sustancia tiene un punto de fusión. El punto de fusión es la temperatura a la que un sólido se convertirá en líquido. A diferentes presiones, se requieren diferentes temperaturas para fundir una sustancia. Cada elemento puro en la tabla periódica tiene un punto de fusión normal, la temperatura a la que el elemento se volverá líquido cuando la presión sea de 1 atmósfera (2).
Punto de ebullición (T b)
Cada sustancia también tiene un punto de ebullición. El punto de ebullición es la temperatura a la que un líquido se evaporará en un gas. El punto de ebullición cambiará en función de la temperatura y la presión. Al igual que el punto de fusión, cada elemento puro tiene un punto de ebullición normal a 1 atmósfera (2).
Presión
También se puede usar presión para cambiar la fase de la sustancia. En la imagen de arriba, tenemos un contenedor equipado con un pistón que sella en un gas. A medida que el pistón comprime el gas, la presión aumenta. Una vez que se haya alcanzado el punto de ebullición, el gas se condensará en un líquido. A medida que el pistón continúa comprimiendo el líquido, la presión aumentará hasta alcanzar el punto de fusión. El líquido luego se congelará en un sólido. Este ejemplo es para un proceso isotérmico donde la temperatura es constante y solo la presión está cambiando.
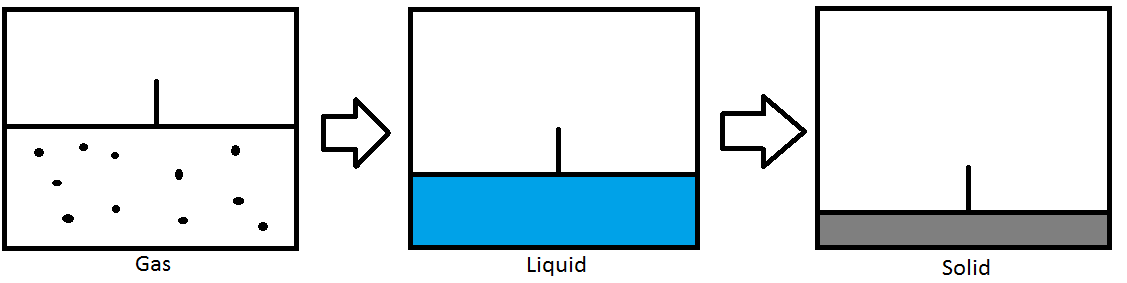
Una breve explicación de un diagrama de fases
La transición de fase se puede representar con un diagrama de fases. Un diagrama de fases es una representación visual de cómo una sustancia cambia de fase.
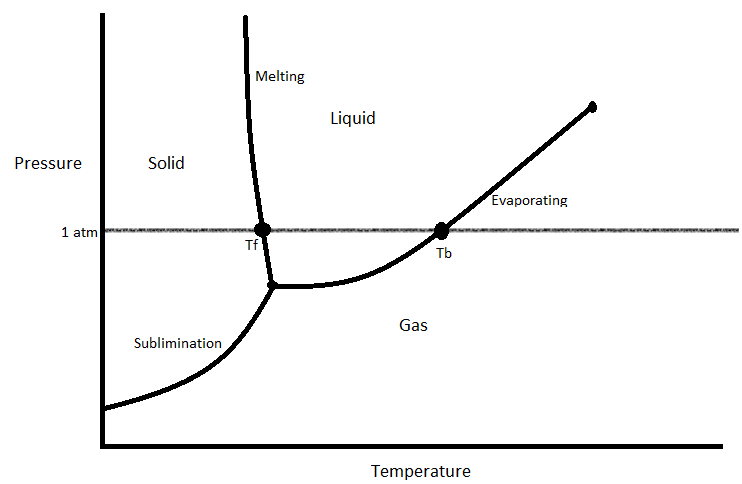
Este es un ejemplo de diagrama de fases. A menudo, cuando se le pregunta sobre una transición de fase, necesitará referirse a un diagrama de fases para responderla. Estos diagramas suelen tener el punto de ebullición normal y el punto de fusión normal marcados en ellos, y tienen las presiones en el eje y y las temperaturas en el eje x. La curva inferior marca las combinaciones de temperatura y presión en las que la sustancia subliminará (1). La izquierda marca las combinaciones de temperatura y presión en las que se fundirá la sustancia (1). Por último, la línea derecha marca las condiciones bajo las cuales se evaporará la sustancia (1).
Referencias
- Olander, Donald R. Termodinámica general. Boca Ratón: CRC, 2008.
- Oxtoby, David W., H. P. Gillis y Alan Campion. “Transición de Fase”. Principios de la Química Moderna. 6a ed. Singapur: Thomson/Brooks/Cole, 2008. 428-30.
- Schmidt, Philip S. La termodinámica: un sistema integrado de aprendizaje. Hoboken, NJ: Wiley, 2006.
- Sherwin, Keith. Introducción a la Termodinámica. Londres: Chapman & Hall, 1994.
Problemas
1. Usando el diagrama de fases para el dióxido de carbono a continuación, explique en qué fase se encuentra normalmente el dióxido de carbono a temperatura y presión estándar, 1 atm y 273.15 K.
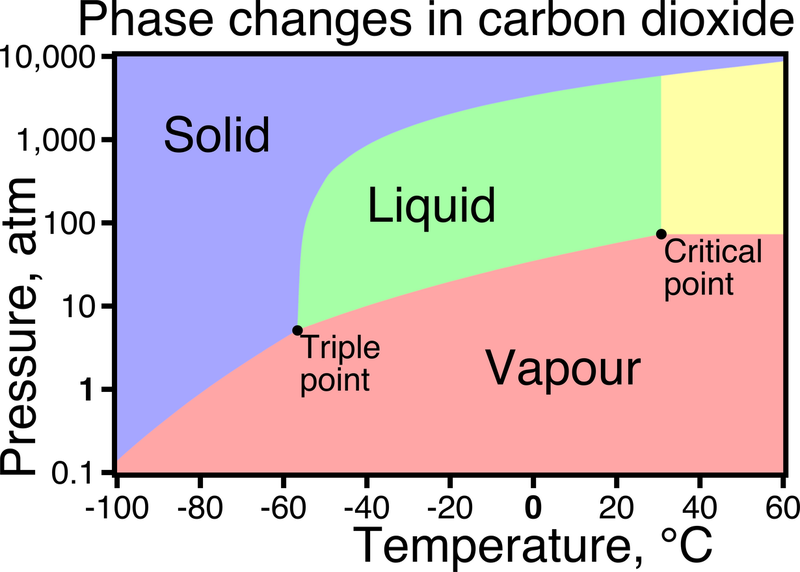
Diagrama de fases para CO2.de Wikipedia.
2: Mirando el mismo diagrama, vemos que el dióxido de carbono no tiene un punto de fusión normal o un punto de ebullición normal. Explique qué tipo de cambio hace el dióxido de carbono a 1 atm y estime la temperatura de este punto.
Soluciones
1: Antes de que podamos responder completamente a la pregunta, necesitamos convertir la información dada para que coincida con las unidades en el diagrama. Primero convertimos 25 grados Kelvin a Celsius:\(K=273.15+C\)\[ 298.15-273.25C\] Ahora podemos mirar el diagrama y determinar su fase. A 25 grados Celsius y 1 atm de dióxido de carbono está en fase gaseosa.
2: El dióxido de carbono se sublima a 1 atm porque pasa de la fase sólida directamente a la fase gaseosa. La temperatura de sublimación a 1 atm es de aproximadamente -80 grados Celsius.
Colaboradores y Atribuciones
- Kirsten Amdahl (UC Davis)

