22.2: Diagramas de fases
- Page ID
- 75195
El diagrama de fases es una representación gráfica de los estados físicos de una sustancia bajo diferentes condiciones de temperatura y presión. Un diagrama de fases típico tiene presión en el eje y y temperatura en el eje x. A medida que cruzamos las líneas o curvas en el diagrama de fases, se produce un cambio de fase. Además, dos estados de la sustancia coexisten en equilibrio en las líneas o curvas.
Introducción
Una transición de fase es la transición de un estado de materia a otro. Hay tres estados de materia: l iquid, sólido y gas.
- Líquido: Un estado de materia que consiste en partículas sueltas y de movimiento libre que forman la forma establecida por los límites del recipiente en el que se encuentra el líquido. Esto sucede porque el movimiento de las partículas individuales dentro de un líquido está mucho menos restringido que en un sólido. Uno puede notar que algunos líquidos fluyen fácilmente mientras que algunos líquidos fluyen lentamente. La resistencia relativa de un líquido al flujo es la viscosidad.
- Sólido: Un estado de materia con partículas apretadas que no cambian la forma o el volumen del recipiente en el que se encuentra. Sin embargo, esto no quiere decir que el volumen de un sólido sea una constante. Los sólidos pueden expandirse y contraerse cuando cambian las temperaturas. Es por ello que cuando se busca la densidad de un sólido, éste indicará la temperatura a la que se enumera el valor de densidad. Los sólidos tienen fuertes fuerzas intermoleculares que mantienen las partículas muy cerca unas de otras. Otra cosa interesante en la que pensar es que todos los sólidos verdaderos tienen estructuras cristalinas. Esto significa que sus partículas están dispuestas en un patrón tridimensional y ordenado. Los sólidos sufrirán cambios de fase cuando se encuentren con cambios de energía.
- Gas: Un estado de materia donde las partículas se esparcen sin forma o volumen definidos. Las partículas de un gas tomarán la forma y llenarán el volumen del recipiente en el que se coloca. En un gas, no hay fuerzas intermoleculares que mantengan unidas las partículas de un gas ya que cada partícula viaja a su propia velocidad en su propia dirección. Las partículas de un gas suelen estar separadas por grandes distancias.
Los diagramas de fases ilustran las variaciones entre los estados de materia de elementos o compuestos en relación con la presión y las temperaturas. A continuación se muestra un ejemplo de un diagrama de fases para un sistema genérico de un solo componente:
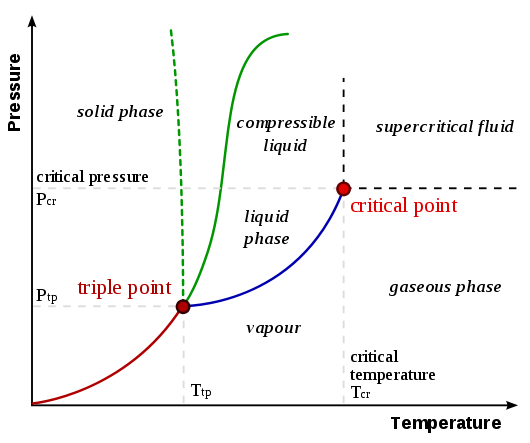
- Punto triple: el punto en un diagrama de fases en el que coexisten los tres estados de la materia: gas, líquido y sólido
- Punto crítico: el punto en un diagrama de fases en el que la sustancia es indistinguible entre los estados líquido y gaseoso
- Curva de fusión (fusión) (o congelación): la curva en un diagrama de fases que representa la transición entre los estados líquido y sólido
- Curva de vaporización (o condensación): la curva en un diagrama de fases que representa la transición entre los estados gaseoso y líquido
- Curva de sublimación (o deposición): la curva en un diagrama de fases que representa la transición entre los estados gaseoso y sólido
Los diagramas de fase representan la presión (típicamente en atmósferas) versus la temperatura (típicamente en grados Celsius o Kelvin). Las etiquetas en la gráfica representan los estados estables de un sistema en equilibrio. Las líneas representan las combinaciones de presiones y temperaturas a las que pueden existir dos fases en equilibrio. Es decir, estas líneas definen puntos de cambio de fase. La línea roja divide las fases sólida y gaseosa, representa la sublimación (sólido a gas) y la deposición (gas a sólido). La línea verde divide las fases sólida y líquida y representa fusión (sólido a líquido) y congelación (líquido a sólido). El azul divide las fases líquida y gaseosa, representa vaporización (líquido a gas) y condensación (gas a líquido). También hay dos puntos importantes en el diagrama, el punto triple y el punto crítico. El punto triple representa la combinación de presión y temperatura que facilita todas las fases de la materia en equilibrio. El punto crítico termina la línea de fase líquido/gas y se relaciona con la presión crítica, la presión por encima de la cual se forma un fluido supercrítico.
Con la mayoría de las sustancias, la temperatura y presión relacionadas con el punto triple se encuentran por debajo de la temperatura y presión estándar y la presión para el punto crítico se encuentra por encima de la presión estándar. Por lo tanto a presión estándar a medida que aumenta la temperatura, la mayoría de las sustancias cambian de sólido a líquido a gas, y a temperatura estándar a medida que aumenta la presión, la mayoría de las sustancias cambian de gas a líquido a sólido
Excepción: Agua
Normalmente la línea de fase sólido/líquido se incline positivamente hacia la derecha (como en el diagrama para el dióxido de carbono a continuación). Sin embargo, para otras sustancias, notablemente el agua, la línea se desvía hacia la izquierda como muestra el diagrama del agua. Esto indica que la fase líquida es más densa que la fase sólida. Este fenómeno es causado por la estructura cristalina de la fase sólida. En las formas sólidas del agua y algunas otras sustancias, las moléculas cristalizan en una red con mayor espacio promedio entre moléculas, resultando así en un sólido con una densidad menor que el líquido. Debido a este fenómeno, uno es capaz de derretir el hielo simplemente aplicando presión y no agregando calor.
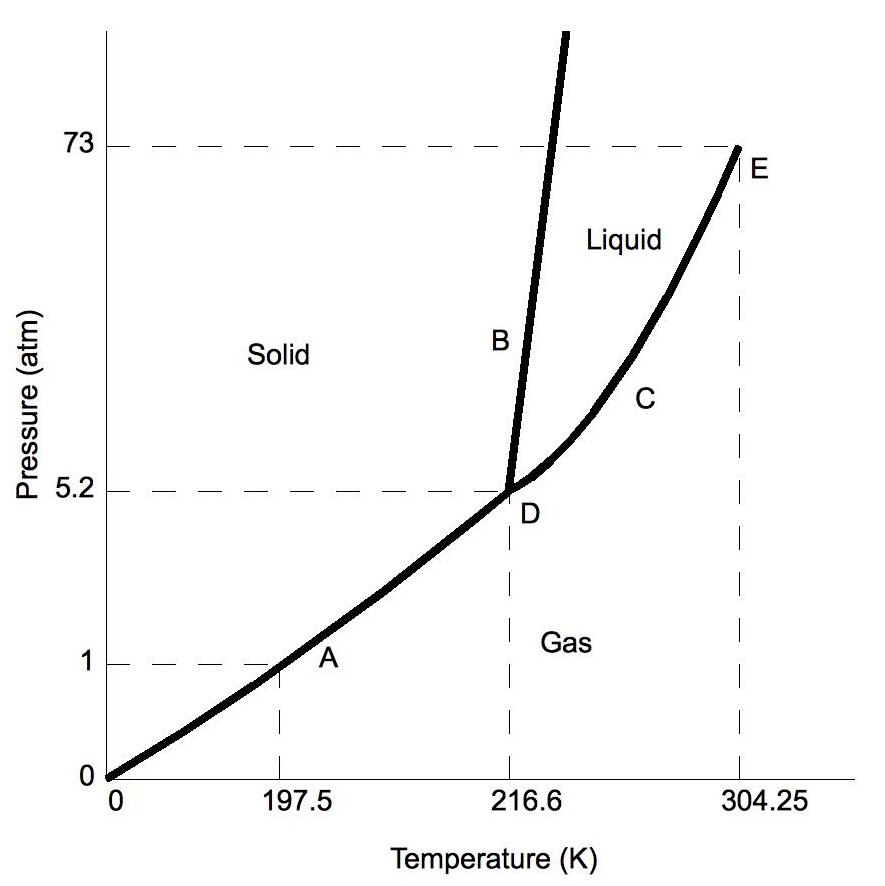
Figura\(\PageIndex{2a}\): Diagramas de fase para CO 2
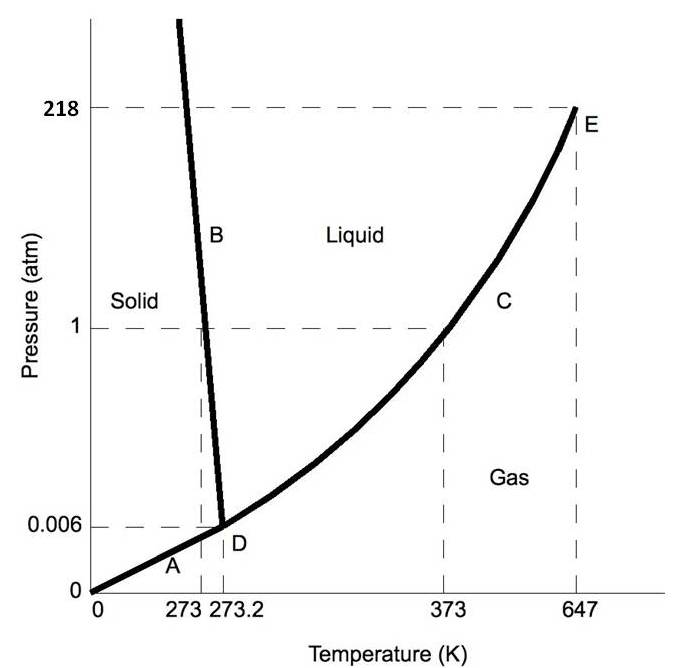
\(\PageIndex{2b}\)Figura:Diagramas de fase para H 2 O
Mover sobre el diagrama
Mover sobre el diagrama de fases revela información sobre las fases de la materia. El movimiento a lo largo de una línea de temperatura constante revela densidades relativas de las fases. Al pasar de la parte inferior del diagrama a la parte superior, la densidad relativa aumenta. El movimiento a lo largo de una línea de presión constante revela las energías relativas de las fases. Al moverse de la izquierda del diagrama a la derecha, las energías relativas aumentan.
Definiciones importantes
- La sublimación es cuando la sustancia pasa directamente del estado sólido al estado gaseoso.
- La deposición ocurre cuando una sustancia pasa de un estado gaseoso a un estado sólido; es el proceso inverso de sublimación.
- La fusión ocurre cuando una sustancia pasa de un estado sólido a un estado líquido.
- La fusión es cuando una sustancia pasa de un estado líquido a un estado sólido, lo contrario a la fusión.
- La vaporización (o evaporación) es cuando una sustancia pasa de un estado líquido a un estado gaseoso.
- La condensación ocurre cuando una sustancia pasa de un estado gaseoso a un estado líquido, al revés de la vaporización.
- Punto crítico: el punto de temperatura y presión en un diagrama de fases donde las fases líquida y gaseosa de una sustancia se fusionan en una sola fase. Más allá de la temperatura del punto crítico, la fase única fusionada se conoce como un fluido supercrítico.
- El Punto Triple se produce cuando tanto la temperatura como la presión de las tres fases de la sustancia coexisten en equilibrio.
Referencias
- Kotz, John C. y Paul Jr. Treichel. Química y Reactividad Química. N.p.: Saunders College Publishing, 1999.
- Oxtoby, David W., H. P. Gillis y Alan Campion. Principios de la Química Moderna. Belmont, CA: Thomson Brooks/? Cole, 2008.
- Petrucci, Ralph y William Harwood. F. Geoffrey Arenque. Jeffry Madura. Química General: Principios y Aplicaciones Modernas. 9a ed. Upper Saddle River, NJ: Pearson, 2007.
- Vollmer, John J. “Fuera de “Thin Air”: Explorando los cambios de fase. ' J. Chem. Educ. 2000: 77, 488A.
Problemas
Imagínese una sustancia con los siguientes puntos en el diagrama de fases: un punto triple a .5 atm y -5°C; un punto de fusión normal a 20°C; un punto de ebullición normal a 150°C; y un punto crítico a 5 atm y 1000°C. La línea de líquido sólido es “normal” (es decir, pendiente positiva). Para ello, complete lo siguiente:
1. Haga un boceto aproximado del diagrama de fases, usando unidades de atmósfera y Kelvin.
- Contestar
-
1-sólido, 2 líquidos, 3 gases, 4 fluidos supercríticos, punto O-triple punto, punto C-crítico -78.5 °C (La fase del hielo seco cambia de sólido a gas a -78.5 °C)
2. Clasificar los estados con respecto al aumento de densidad y aumento de energía.
3. Describir lo que se vería a presiones y temperaturas superiores a 5 atm y 1000°C.
- Contestar
-
Uno vería un fluido supercrítico, al acercarse al punto, uno vería desaparecer el menisco entre el líquido y el gas.
4. Describir lo que sucederá con la sustancia cuando comience en un vacío a -15°C y se presurice lentamente.
- Contestar
-
La sustancia comenzaría como un gas y a medida que aumenta la presión, se comprimiría y eventualmente solidificaría sin licuarse ya que la temperatura está por debajo de la temperatura del punto triple.
5. Describir los cambios de fase de -80°C a 500°C a 2 atm.
- Contestar
-
La sustancia se fundiría en algún lugar alrededor, pero por encima de 20°C y luego herviría en algún lugar alrededor, pero por encima de 150°C. No formaría un fluido supercrítico ya que ni la presión ni la temperatura alcanzan la presión o temperatura críticas.
6. ¿Qué existe en un sistema que está a 1 atm y 150°?
- Contestar
-
Dependiendo de la cantidad de energía que haya en el sistema, habrá diferentes cantidades de líquido y gas en equilibrio. Si solo se agregara la energía suficiente para elevar la temperatura del líquido a 150°C, solo habrá líquido. Si se agregó más, habrá algo de líquido y algo de gas. Si solo se agregara la energía suficiente para cambiar el estado de todo el líquido sin elevar la temperatura del gas, solo habrá gas.
7. Etiquete el área 1, 2, 3 y 4 y los puntos O y C en el diagrama.
8. Una muestra de hielo seco (CO 2 sólido) se enfría a -100 °C, y se coloca sobre una mesa a temperatura ambiente (25 °C). ¿A qué temperatura es la misma tasa de sublimación y deposición? (Supongamos que la presión se mantiene constante a 1 atm).
Colaboradores y Atribuciones
- Matthew McKinnell (UCD), Jessie Verhein (UCD), Pei Yu (UCD), Lok Ka Chan (UCD), Jessica Dhaliwal (UCD), Shyall Bhela (UCD), Candace Wong-Sing (UCD)

