1.1: De Demócrito al Siglo XIX- Desarrollos Históricos en Química
- Page ID
- 80669
La química es el estudio del mundo material. ¿De qué están hechos los diferentes materiales? ¿Cómo se relaciona su composición y estructura con sus propiedades? ¿Cómo se transforma un material en otro? Estas son las clases de preguntas que han impulsado el desarrollo de la química.
La gente lleva mucho tiempo usando la química. Los medicamentos se obtuvieron de plantas en las primeras sociedades de todo el mundo. La gente hacía tintes para ropa y pinturas para casas. La metalurgia se practicaba en la India y el Sahel, en África, antes del 1000 a.C.
El filósofo griego, Demócrito, suele ser citado como la primera persona en formular una idea de átomos, aunque ideas similares se registraron en la India aproximadamente al mismo tiempo. Demócrito pensó que todas las cosas estaban hechas de átomos. Los átomos eran muy pequeños, pensó. También eran indivisibles. Si bien podrías cortar un trozo de madera por la mitad, y cortar cada una de esas piezas por la mitad, en algún momento llegarías a la etapa en la que ya no se podía cortar la madera, porque tenías una rebanada de un átomo de espesor.
Había una infinita variedad de átomos, pensó Demócrito, conformando una infinita variedad de materiales en el mundo. Las propiedades de esos átomos fueron directamente responsables de las propiedades de los materiales. El agua estaba hecha de átomos de agua, y los átomos de agua eran resbaladizos. El hierro estaba hecho de átomos de hierro, y los átomos de hierro eran fuertes y duros.
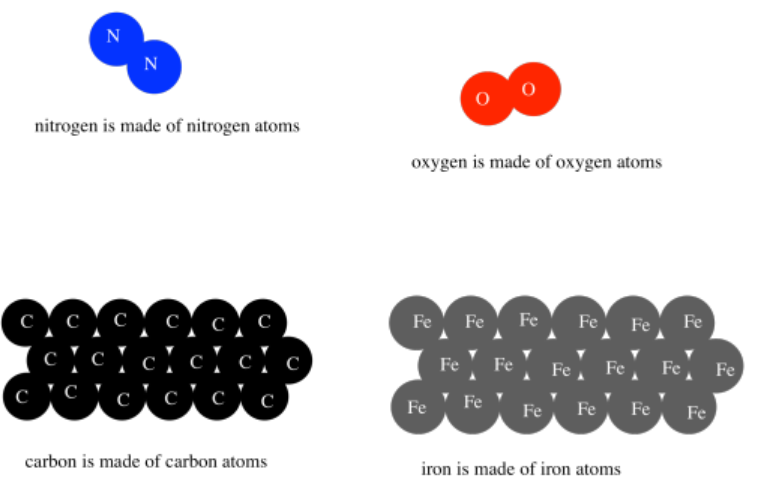
Hoy en día no pensamos exactamente en los materiales de la misma manera, pero hemos conservado algunas de las raíces de estas ideas. Por ejemplo, sí sabemos que la materia está compuesta por átomos, y que hay diferentes tipos de átomos que hacen diferentes materiales. Sin embargo, también sabemos que esos átomos pueden combinarse entre sí de diferentes maneras para hacer muchos materiales diferentes.
Todos los materiales en el mundo que nos rodea están hechos de átomos.
Un aspecto más práctico de la química tiene sus raíces en la Edad de Oro islámica. Practicantes como Jabir Ibn Hayyan desarrollaron aparatos de laboratorio y métodos experimentales para recristalizar y destilar compuestos de fuentes naturales. Al igual que Demócrito, estos primeros químicos querían saber de qué está hecho el mundo, pero también estaban tratando de hacer mejoras en aplicaciones prácticas como curtir cuero, hacer vidrio o hierro a prueba de herrumbre.
Los productos naturales son ampliamente utilizados en aplicaciones alimentarias, medicinales e industriales. Consulta si puedes hacer coincidir los siguientes productos naturales con su fuente original y natural.
i. vainillina a. granos de café
ii. cafeína b. corteza de sauce
iii. poliisopreno c. plantas índigo
iv. aspirina d. agujas de tejo
v. tanino e. vainas de vainilla
vi. el agente quimioterapéutico, paclitaxel f. árboles de caucho
vii. tinte azul para jeans g. roble
La traducción de textos árabes al latín ayudó a impulsar el Renacimiento europeo. Observaciones prácticas de la época islámica, como el hecho de que la materia podía convertirse en diferentes formas pero no desaparecer, dieron lugar a algunas de las ideas más fundamentales de la química moderna.
- Conservación de la masa: la materia se puede convertir de una forma a otra, pero no desaparece.
Como suele ser cierto en la ciencia, los nuevos desarrollos de la química se basaron en trabajos anteriores así como en el trabajo de colegas contemporáneos, mejorando continuamente nuestra comprensión de la naturaleza en pequeños pasos. En los años 1600, Robert Boyle adoptó el énfasis islámico en el trabajo experimental. Entre sus experimentos, pudo aislar el gas hidrógeno formado por la reacción de metales con ácidos, como estaban haciendo otros científicos en ese momento. En la década de 1700, Joseph Priestley aisló varios “aires” o gases diferentes, incluido el oxígeno. Henry Cavendish demostró que el hidrógeno se combinaba con el oxígeno para formar agua. Antoine Lavoisier argumentó que el oxígeno y el nitrógeno, el otro componente principal del aire, son elementos —materiales que no pueden fabricarse a partir de ningún otro tipo de átomo. En contraste, el agua no era un elemento, porque se podía hacer combinando átomos de oxígeno e hidrógeno. El libre intercambio de ideas permitió a las personas avanzar rápidamente en nuestra comprensión del mundo material.
Lavoisier, en particular, fue importante para reunir una serie de ideas importantes. Afirmó claramente que los elementos son la unidad básica de la materia, que no se puede obtener de otros materiales. Los compuestos se elaboraron combinando diferentes elementos. Su cuidadoso uso de una balanza para pesar reactivos y productos de un experimento confirmó claramente la idea de conservación de la masa: la masa total de productos después de una reacción equivale a la masa total de reactivos. Estas conclusiones fueron versiones más sofisticadas de ideas anteriores, y Lavoisier pudo presentarlas de una manera que finalmente obtuvo una amplia aceptación.
- Un compuesto es una mezcla de diferentes elementos unidos entre sí.
- Conservación de la masa, revisada: la masa total de productos después de una reacción equivale a la masa total de reactivos.
En el 1800 uno de los principales defensores de la teoría atómica en desarrollo fue John Dalton. Avanzó la idea de que todos los átomos de un elemento en particular son idénticos (hasta donde pudo decir en ese momento). Un elemento es un bloque de construcción atómico fundamental del que están hechos otros materiales. Dalton realizó análisis para tratar de deducir los pesos atómicos de diferentes elementos. Tomando juntas estas ideas, demostró que un compuesto particular siempre contenía los mismos elementos en la misma proporción.
- Un elemento es un bloque de construcción atómico fundamental del que están hechos otros materiales.
- Un compuesto es una mezcla de diferentes elementos unidos entre sí en una proporción específica.
- Un compuesto puede tener un número específico de átomos de un tipo combinado con un número específico de átomos de otro tipo.
- Debido a que todos los átomos tienen peso, también podemos pensar en un compuesto como un peso específico de un tipo de elemento combinado con un peso específico de otro elemento.
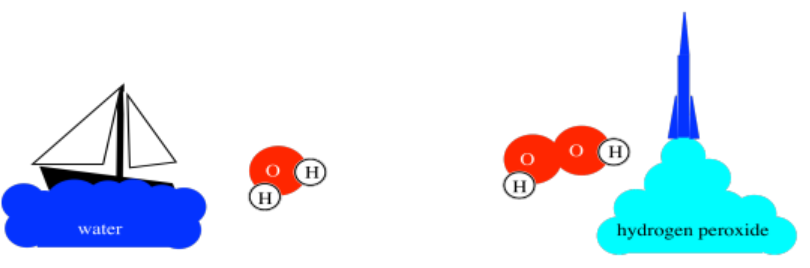
Por ejemplo, el agua es un compuesto hecho de hidrógeno y oxígeno. Es crucial para la vida, claro. El agua es aproximadamente 1/9º de hidrógeno en peso; los otros 8/9 son oxígeno. Sin embargo, un compuesto diferente, el peróxido de hidrógeno, es un combustible para cohetes. El peróxido de hidrógeno es solo alrededor de 1/19 de hidrógeno en peso. Esas relaciones específicas de hidrógeno a oxígeno son cualidades inherentes a cada compuesto.
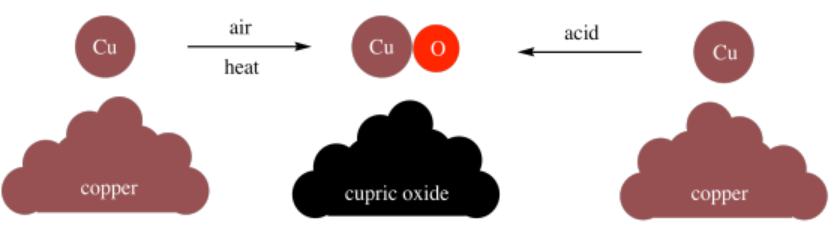
Además, Dalton encontró que podía hacer compuestos a través de diferentes métodos. Por ejemplo, podría hacer óxido cúprico (CuO) calentando cobre en aire, o podría hacerlo a través de diversas reacciones que involucran cobre y ácidos. No importaba cómo elaboraba el óxido cúprico; la relación de cobre a oxígeno siempre fue la misma en el producto.
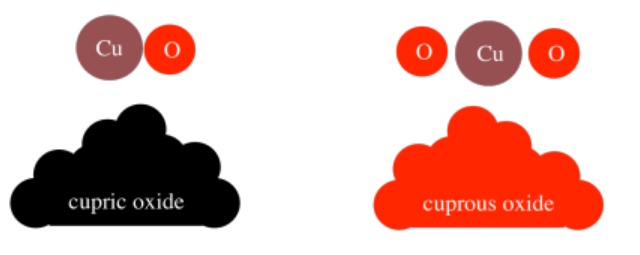
Hay otro compuesto que contiene cobre y oxígeno en una proporción diferente; se llama óxido cuproso, y tiene la fórmula Cu 2 O. Sin embargo, es muy diferente al óxido cúprico. La diferencia más obvia es que el óxido cuproso es rojo mientras que el óxido cúprico es negro. Una vez más, cuando los elementos se combinan en diferentes proporciones, se producen diferentes materiales, y tienen propiedades que difieren entre sí y de ellos elementos de los que están compuestos.
Las proporciones se utilizan comúnmente en la cocción. Por lo general, los ingredientes deben combinarse en las proporciones correctas para hacer brownies o un pastel.
Brownies: Pastel:
1 taza de azúcar 1 taza de azúcar
2 huevos 2 huevos
1/2 taza de mantequilla 1/2 taza de mantequilla
1/2 cucharadita de vainilla 1/2 cucharadita de vainilla
1/2 taza de harina 1-1/2 taza de harina
1/3 taza de cacao 1/2 taza de cacao
1/4 cucharadita de polvo de hornear 1 cucharadita de polvo de hornear
1/4 cucharadita de sal 1/4 cucharadita de sal
1/4 cucharadita de bicarbonato de sodio
1 c agua hirviendo
- Los brownies y el pastel tienen muchos ingredientes en común. Mirando esos ingredientes que se encuentran tanto en los brownies como en el pastel, ¿ves alguna diferencia en las proporciones utilizadas? ¿Cómo crees que eso afecta las propiedades del producto?
- La receta de pastel anterior es solo para un molde para pasteles poco profundo. Si quisieras un pastel de dos capas, ¿qué harías con la receta?
- Supongamos que está limpiando su refrigerador y quiere convertir todos sus huevos en brownies. Si la receta anterior hace dieciséis brownies de 2" x 2", ¿cuántos brownies podrías hacer con una docena de huevos? ¿Cuánta harina necesitarías para lograr tu objetivo?
- Quieres hacer unos brownies pero no tienes tazas medidoras ni cucharas. Te das cuenta de que hay un muy buen equilibrio en el laboratorio de química y decides medir tus ingredientes ahí (es una idea terrible, por cierto). Encontrará una lista de conversiones, incluyendo lo siguiente:
1 taza de harina = 125 g; 1 taza de azúcar = 200 g; 1 taza de cacao = 90 g.
¿Cuántos gramos de harina, azúcar y cacao necesitarías usar para un lote de brownies?
e) ¿Por qué crees que una taza de harina no pesa lo mismo que una taza de azúcar o una taza de cacao?
El mercurio forma dos compuestos diferentes con el oxígeno: el óxido mercúrico (HgO, que es rojo) y el óxido de mercurio (Hg 2 O, que es negro).
- ¿Cuántos átomos de mercurio se combinan con un átomo de oxígeno para formar una unidad de óxido mercúrico, HgO?
- ¿Cuántos átomos de mercurio se combinan con un átomo de oxígeno para formar una unidad de óxido de mercurio, Hg 2 O?
- Dados los siguientes pesos atómicos aproximados, ¿cuál es el peso total de una unidad de óxido mercúrico? 1 átomo de mercurio (Hg): 200 amu; 1 átomo de oxígeno (O): 16 amu
- ¿Cuál es el peso de una unidad de óxido de mercurio?
- Respuesta a:
-
un átomo de mercurio con un átomo de oxígeno
- Respuesta b:
-
dos átomos de mercurio con un átomo de oxígeno
- Respuesta c:
-
200 amu (Hg) + 16 amu (O) = 216 amu (HGo)
- Respuesta d:
-
2 x 200 amu (Hg) + 16 amu (O) = 416 amu (HGo)
Es bastante difícil pesar un átomo individual. Debido a que estamos trabajando con ratios, siempre podemos escalar y mantener la proporción de átomos igual, y solo haremos más del compuesto que queremos. En lugar de pesar las cosas en unidades de masa atómica, usualmente las pesamos en gramos.
1 átomo de mercurio (Hg): 200 amu; 1 mol de mercurio: 200 g
1 átomo de oxígeno (O): 16 amu; 1 mol de oxígeno (O): 16 g
1 átomo de hidrógeno (H): 1 amu; 1 mol de hidrógeno (H): 1 g
200 amu de Hg más 16 amu de O hacen 216 amu de HGo, que está justo en unidad de HGo. Un átomo de mercurio pesa 200 amu y un átomo de oxígeno pesa 16 amu, por lo que un átomo de mercurio combinado con un átomo de oxígeno pesa 216 amu.
Un mol de mercurio pesa 200 g. Un mol de átomos de oxígeno pesa 16 g. Un mol es solo un lote de átomos a escala; es solo el número de masa atómica del átomo, pero pesa en gramos en lugar de amu.
- ¿Cuánto pesa un mol de HGo?
- ¿Cuántos gramos de mercurio se necesitarían para hacer un mol de Hg 2 O?
- ¿Cuántos gramos de mercurio se necesitarían para hacer 0.25 moles de HGo?
- ¿Cuántos gramos de oxígeno se necesitarían para hacer 2.08 g Hg 2 O?
- Respuesta a:
-
200 g (Hg) + 16 g (O) = 216 g (HGo)
- Respuesta b:
-
2 x 200 g (Hg) + 16 g (O) = 416 g (Hg 2 O)
- Respuesta c:
-
Si un mol es 216 g de HGo, entonces 0.25 mol debe ser un cuarto de esa cantidad, o 54 g.
0.25 mol x 216 g/mol = 54 g
Alternativamente escrito como
0.25 mol x 216 g mol -1 = 54 g
La cantidad de mercurio es apenas una fracción de eso: 200/216. Entonces la respuesta es (200/216) x 54 g = 50 g.
- Respuesta d:
-
¿Qué fracción de un mol es 2.08 g de Hg 2 O, si un mol es 416 g?
2.08 g/416 g mol -1 = 0.005 mol
Observe que cuando dividimos g por g mol -1, los gramos se cancelan y el mol -1 se convierte en mol.
Hay 1 mol de O en 1 mol de HgO, por lo que se necesitan 0.005 moles de O para 0.005 mol de HgO.
0.005 mol x 16 g mol -1 = 0.08 g O necesario
Priestley aisló oxígeno calentando óxido mercúrico. ¿Cuánto oxígeno podría hacerse calentando 1 g de HGo?
A finales del siglo XIX, se habían aislado suficientes elementos diferentes para que la gente comenzara a notar patrones en sus propiedades. Si enumeró los elementos por peso, los elementos con propiedades similares parecían ocurrir a intervalos regulares a lo largo de la lista. A un profesor ruso de química, Dmitri Mendeleev, se le ocurrió una manera convincente de transmitir esta “periodicidad” en una mesa. Esta es la tabla periódica moderna (un ejemplo se muestra en la figura\(\PageIndex{1}\)).
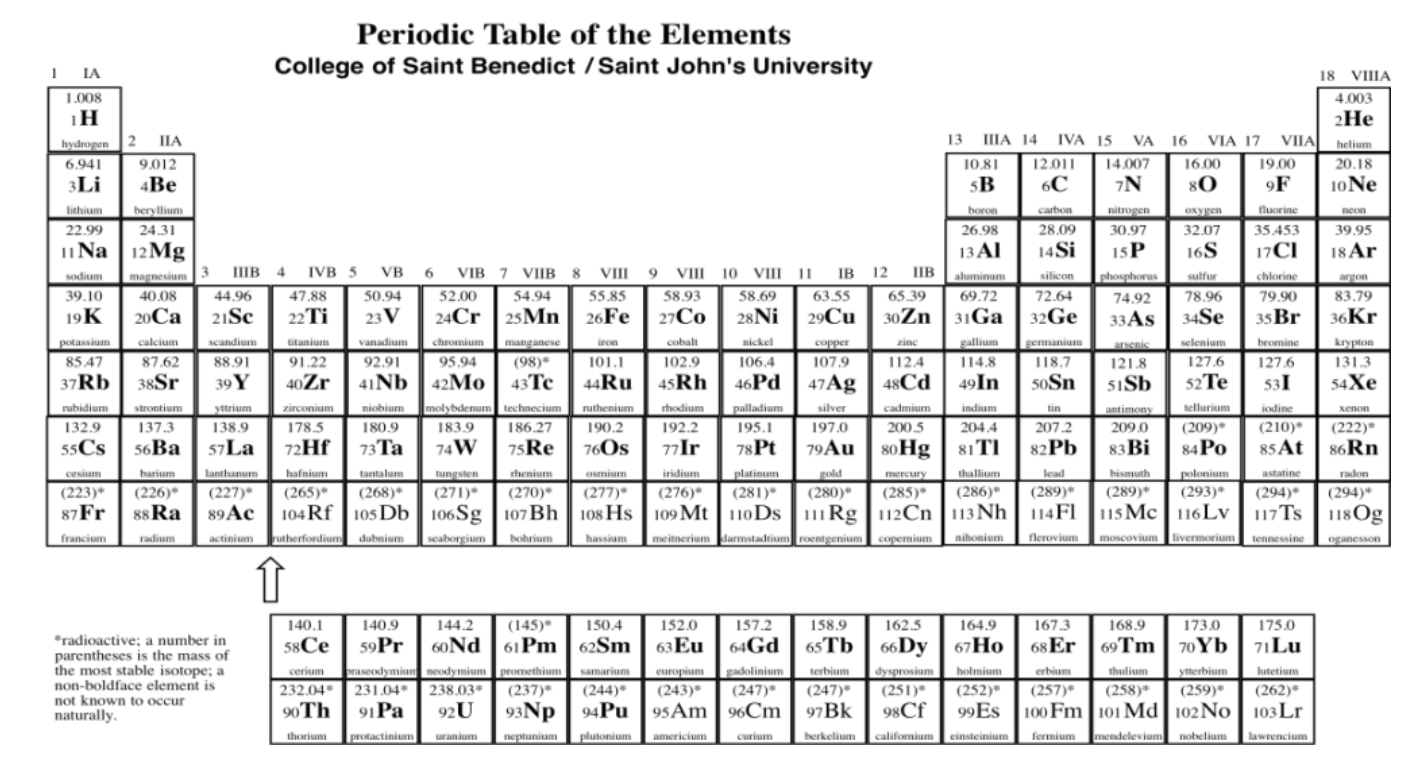
Descargar copia de la tabla periódica.
Los gases nobles son un ejemplo de uno de los grupos en la tabla periódica. Tienen una serie de propiedades en común. Como su nombre indica, todos los gases nobles existen en fase vapor a temperatura ambiente normal. Todos son bastante poco reactivos; no sufren cambios químicos muy fácilmente. En términos de estructura, cada uno existe como átomos individuales en la naturaleza. El resto de los elementos de la tabla periódica no existen realmente como átomos individuales en la naturaleza. De una forma u otra, se agrupan junto con otros átomos. Pueden agruparse con otros átomos del mismo tipo, formando un elemento, o bien formar grupos con átomos de diferentes tipos, formando compuestos. Los gases nobles rara vez hacen alguna de esas cosas.
Por sus cualidades similares, Mendeleev juntó los gases nobles en una columna de la tabla periódica. Son helio, neón, argón, kriptón, xenón y radón.

- ¿Cuáles de los siguientes elementos están en el mismo grupo que el oxígeno: silicio, azufre o neón?
- ¿Cuál de los siguientes elementos tendría propiedades similares al carbono: silicio, nitrógeno, sodio?
- ¿Cuál de los siguientes elementos tendría propiedades similares al magnesio: calcio, litio, potasio?
- ¿Cuál de los siguientes elementos tendría propiedades similares al sodio: nitrógeno, potasio, litio?
- ¿Cuál de los siguientes elementos tendría propiedades similares al nitrógeno: oxígeno, fósforo, rubidio?
- ¿Cuáles de los siguientes elementos están en el mismo grupo que el flúor: argón, yodo o neón?
- ¿Cuáles de los siguientes elementos están en el mismo grupo que el oro: plata, cobre, zinc?
- ¿Cuáles de los siguientes elementos están en el mismo grupo que el hierro: rutenio, cobre, oro?
- Respuesta a:
-
azufre
- Respuesta b:
-
silicio
- Respuesta c:
-
calcio
- Respuesta d:
-
Potasio y Litio
- Respuesta e:
-
fósforo
- Respuesta f:
-
yodo
- Respuesta g:
-
plata y cobre
- Respuesta h:
-
rutenio
De manera similar, los químicos comenzaron a pensar en otras columnas de la tabla periódica como pertenecientes en grupos. En ocasiones, a estos grupos se les daban nombres específicos, como los gases nobles. Están los halógenos, que significa “saleros”, porque a menudo estaban contenidos en sales. Están los calcógenos, “oreros”, que se encuentran en los óxidos de hierro como la hematita y la taconita, por ejemplo. Están los pnictógenos, “hacedores de estrangulamiento”, llamados así después del descubrimiento de que el aire está compuesto principalmente por nitrógeno, pero el nitrógeno no es la parte del aire que respiramos. Otros grupos se denominan simplemente el “grupo carbono” o “grupo boro” autoexplicativo después del primer elemento de la columna.
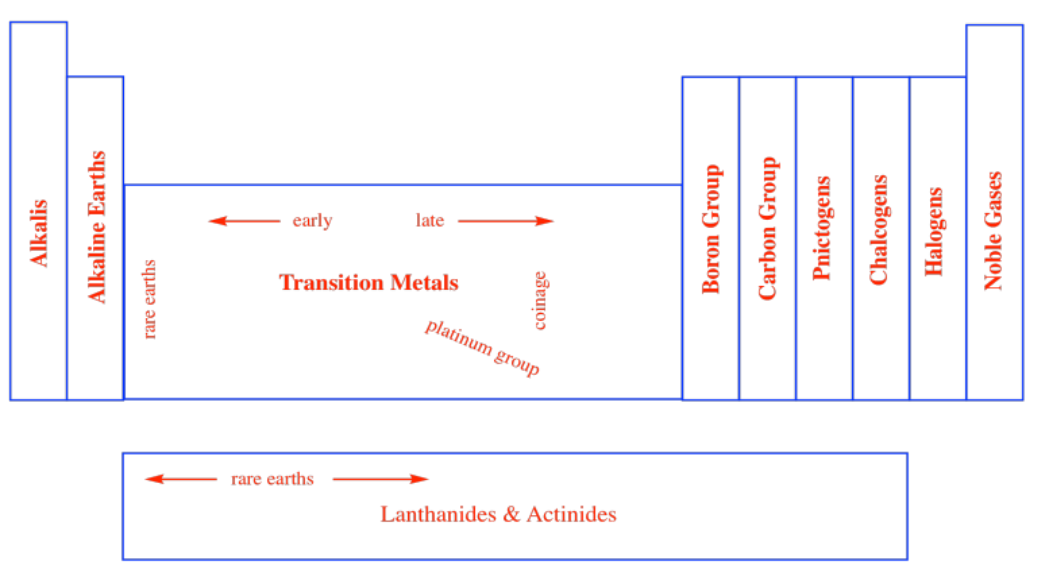
Alternativamente, las columnas de la tabla periódica suelen estar numeradas. En un momento, las columnas se separaron en diferentes grupos, con enfoque específico en dos de ellos: el grupo principal y los metales de transición. El grupo principal fue el Grupo A y los metales de transición constituyeron el Grupo B. Cada columna sucesiva a través de estos bloques de la tabla periódica se numeró con números romanos.
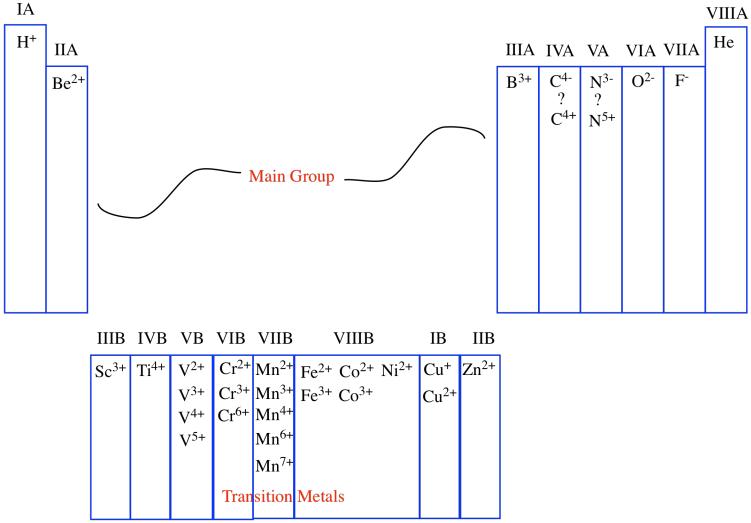
Una de esas propiedades periódicas que se encuentra en cada columna es la carga habitual sobre un ion. Los átomos a veces capturan electrones adicionales, que son partículas subatómicas cargadas negativamente, volviéndose cargadas negativamente en general. Otros átomos a veces pierden sus electrones, volviéndose cargados positivamente como resultado. Hasta cierto punto, el número de columna corresponde a la carga sobre los iones comunes que se encuentran en esa columna. Por ejemplo, en la primera columna, los átomos casi siempre se encuentran como iones con una carga +1; en la segunda columna, los átomos casi siempre se encuentran como iones con una carga +2, y así sucesivamente.
Esa correlación se descompone después de un tiempo. En ocasiones, como en los metales de transición, el número de grupos simplemente denota la mayor carga posible sobre un ion, aunque puede haber muchos iones posibles que se observan comúnmente. Eventualmente, a medida que avanzamos hacia la derecha, la correlación entre el número de grupo y la carga se descompone por completo. En el grupo principal, los átomos más a la derecha no son cationes en absoluto, sino aniones. Algunos, como el carbono y el nitrógeno, pueden considerarse formalmente como aniones o cationes, dependiendo de su entorno.
En cierto sentido, aunque nos gusta estar organizados y numerar las cosas de izquierda a derecha, la tabla periódica se organiza naturalmente desde los bordes hacia adentro. Los átomos más cercanos al borde izquierdo construyen carga positiva de acuerdo a lo lejos que estén del borde. Los átomos más cercanos al borde derecho construyen carga negativa de acuerdo a lo lejos que estén del borde. Sin embargo, los átomos en el medio varían mucho más.
Esta orientación de borde está relacionada con la estabilidad de los gases nobles y lo que se llama “configuraciones de concha llena”. Llegaremos a esos, y a las razones físicas de su estabilidad, en una página posterior.
Ahora, eventualmente en la ciencia, alguien siempre decide que hay una mejor manera de hacer las cosas, y así que si acabas de comprar una tabla periódica completamente nueva para exhibir en la pared de tu habitación, es posible que veas los números arábigos 1-18 en la parte superior. Este sistema está destinado a ser una forma más simple y limpia de hacer las cosas. (Y una vez más, los lantánidos y actínidos, esas dos filas solitarias huérfanas al pie de la tabla periódica, son más o menos ignoradas. Eso en parte porque, por razones que son un poco complicadas en este momento, en su mayoría se comportan como si formaran parte del Grupo 3.)
Entonces, las columnas de la tabla periódica están diseñadas para mostrarnos qué elementos están relacionados entre sí. ¿Qué más se muestra en la tabla? Si miramos solo un cuadrado de la tabla periódica, podemos ver lo que nos dice de un elemento individual.
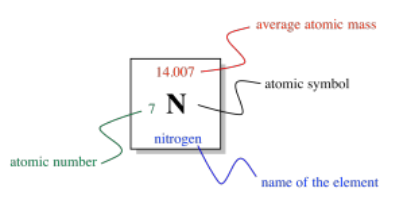
En medio de la plaza, hay una letra romana o un par de letras romanas. La primera letra es siempre una mayúscula romana. Esta designación de una o dos letras es el símbolo atómico. Por lo general, es el primer par de letras en el nombre del átomo, aunque el nombre no siempre está en inglés. Por ejemplo, el símbolo para mercurio es Hg, para hidrargiro. Ese es el nombre latino, que significa, más o menos, “plata líquida”.
Por encima del símbolo, o a veces arriba y a la izquierda, está el peso atómico del átomo. La masa atómica es una de las propiedades de un elemento, pero resulta que un elemento dado puede tener un rango de pesos atómicos. En consecuencia, el peso promedio se muestra en la tabla periódica. Por ejemplo, el átomo más pequeño, hidrógeno, puede tener un peso de 1, 2 o 3 unidades de masa atómica (o amu). El peso promedio de un átomo de hidrógeno es de 1.008 amu. Ese hecho nos dice que la mayoría de los átomos de hidrógeno por ahí tienen un peso de 1 amu; relativamente pocos de ellos tienen pesos atómicos de 2 amu o 3 amu.
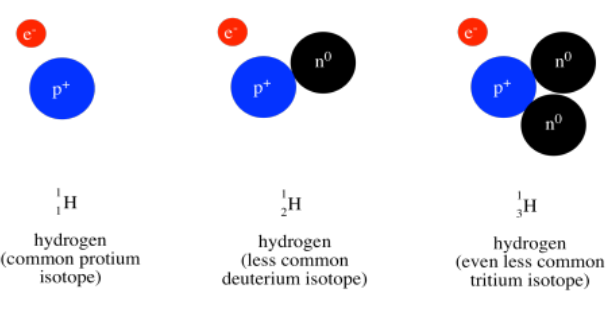
La mayor parte de la masa de un átomo proviene del núcleo del átomo, donde se encuentran partículas relativamente pesadas, los protones y neutrones. Los átomos de hidrógeno siempre contienen un protón, con una masa de 1 amu, pero también pueden contener números variables de neutrones, que también tienen una masa de 1 amu.
(Muchos científicos prefieren el término “masa” cuando se habla de átomos, reservando el término “peso” para describir lo pesado que se siente algo por el tirón de la gravedad. Aquí, usaremos el término “fuerza debida a la gravedad” si queremos discutir este último concepto.)
El número a la parte inferior izquierda se llama el número atómico. Observe que cada elemento de la tabla periódica tiene un número asignado del 1 al 112. Los elementos están numerados en orden de “más pequeños” a “más grandes”, en términos generales. El elemento 1, hidrógeno, es el más pequeño, y el elemento 112, el copernio, es el más grande (al menos, eso es hasta donde han llegado hasta ahora los equipos de químicos y físicos que buscan nuevos elementos). Más correctamente, el número atómico simplemente nos dice el número de protones en el núcleo de un átomo de un elemento dado. El hidrógeno siempre tiene un protón; el copernio siempre tiene 112 de ellos.
Por último, el nombre del elemento puede o no ser escrito en la tabla periódica. Los otros tres datos siempre están ahí. En ocasiones se da información adicional, como propiedades específicas del elemento.
Suministrar la siguiente información sobre cada elemento.
- El número atómico de calcio.
- El símbolo atómico del sodio.
- La masa atómica del oxígeno.
- El nombre de P.
- El nombre del elemento 6.
- El símbolo del estaño.
- La masa atómica del azufre.
- El nombre de K.
- Respuesta a:
-
20
- Respuesta b:
-
Na
- Respuesta c:
-
16.00
- Respuesta d:
-
fósforo
- Respuesta e:
-
carbono
- Respuesta f:
-
Sn
- Respuesta g:
-
32.07
- Respuesta h:
-
potasio
La tabla periódica tal y como lo presentó Mendeleev tuvo valor predictivo. Se presentaron las relaciones estructura-propiedad de los átomos. Si supieras algo sobre un elemento de la tabla, te llevaría a creer que otros elementos de la misma columna tendrían propiedades similares. Además, había brechas en la tabla donde debería haber un elemento, pero no se conocía ninguno. Se predijo que estos elementos eventualmente serían descubiertos, y lo fueron.
Sin embargo, la gente no estaba satisfecha con la idea del átomo como el bloque básico de construcción del universo. La gente quería saber cómo se hacían los átomos mismos. En última instancia, responder a esta pregunta dependía del desarrollo de la mecánica cuántica. Aprenderemos un poco más sobre esa visión del átomo a continuación.
¿Cuál es el peso aproximado, al g más cercano, de un mol de cada uno de los siguientes elementos?
a) neón, Ne, encontrado en letreros de tiendas de colores brillantes
b) hierro, Fe, utilizado para fabricar acero
c) cobre, Cu, encontrado en líneas eléctricas
d) oro, Au, encontrado en bisutería
e) silicio, Si, utilizado en dispositivos de alta tecnología
- Respuesta a:
-
Ne: 20 g/mol
- Respuesta b:
-
Fe: 56 g/mol
- Respuesta c:
-
Cu: 64 g/mol
- Respuesta d:
-
Au: 197 g/mol
- Respuesta e:
-
Si: 28 g/mol
¿Cuál es el peso, al gramo más cercano, de un mol de cada uno de los siguientes compuestos?
a) agua, H 2 O
b) bicarbonato de sodio, NaHCO 3
c) arena, que es principalmente sílice, SiO 2
d) sal de mesa, NaCl
e) nitruro de tantalio, TaN, utilizado en electrónica
f) amoníaco, NH 3, encontrado en algunas soluciones de limpieza
g) dihidrogenofosfato de sodio, NaH 2 PO 4, utilizado en pasta de dientes
h) ácido acético, CH 3 CO 2 H, que se disuelve en agua para hacer vinagre.
- Respuesta a:
-
H 2 O: 18 g/mol (2 x Al+ 1 x O = 2 x 1 + 1 x 16 g/mol)
El peso molar del átomo se redondeó al gramo más cercano. Para tener mucho cuidado y evitar la “propagación de errores”, se podría utilizar el peso molar más exacto (a varios decimales) y se podría realizar el redondeo después del cálculo. En estos casos, el resultado sería el mismo. El resultado podría ser diferente si se encontraran números muy grandes de átomos en el compuesto.
- Respuesta b:
-
NaHCO 3: 84 g/mol (3 x O + 1 x Na + 1 x Al + 1 x C = 3 x 16 + 1 x 23 + 1 x 1 + 1 x 12 g/mol)
- Respuesta c:
-
SiO 2: 60 g/mol (1 x Si + 2 x O = 1 x 28 + 2 x 16 g/mol)
- Respuesta d:
-
NaCl: 58 g/mol (1 x Na + 1 x Cl = 1 x 23 + 1 x 35 g/mol)
- Respuesta e:
-
TaN: 195 g/mol (1 x Ta + 1 x N = 1 x 181 + 1 x 14 g/mol)
- Respuesta f:
-
NH 3: 17 g/mol (1 x N + 3 x H = 1 x 14 + 3 x 1 g/mol)
- Respuesta g:
-
NaH 2 PO 4:120 g/mol (1 x Na + 2 x Al + 1 x P + 4 x O = 1 x 23 + 2 x 1 + 1 x 31 + 4 x 16 g/mol)
- Respuesta h:
-
CH 3 CO 2 H: 60 g/mol (2 x C + 4 x H + 2 x O = 2 x 12 + 4 x 1 + 2 x 16 g/mol)

