1.2: Mecánica Cuántica Antigua- Desarrollos Básicos
- Page ID
- 80670
Hoy en día, sabemos que los átomos contienen protones, neutrones y electrones. Los protones tienen una masa significativa y una carga positiva y se encuentran en el núcleo del átomo. Los neutrones tienen masa pero sin carga y también se encuentran en el núcleo. Los electrones tienen carga negativa y muy poca masa y se encuentran fuera del núcleo del átomo. El peso de un átomo en unidades de masa atómica es aproximadamente la suma de sus protones y neutrones, ya que los electrones no tienen mucha masa.
Por ejemplo, un átomo de carbono típico tiene seis protones y seis neutrones, y tiene un peso atómico de 12 amu. Un carbono también tiene seis electrones, pero son tan pequeños que no contribuyen al peso del carbono.
- Un elemento se define por el número de protones en su núcleo.
- El número de protones en un átomo es igual al número de electrones, para equilibrar la carga.
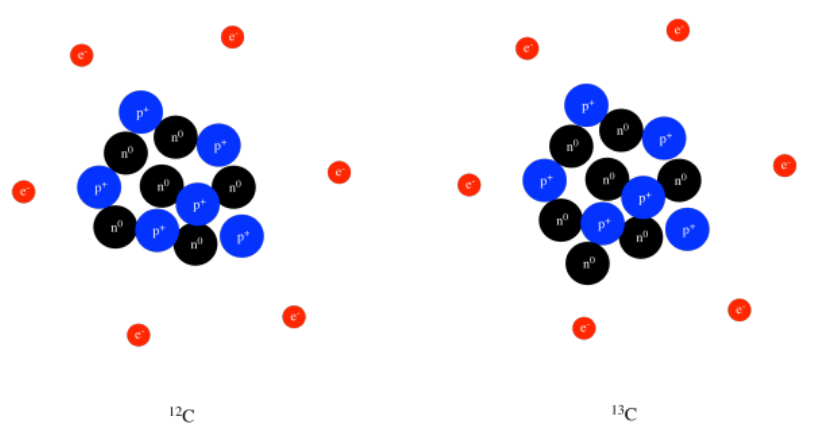
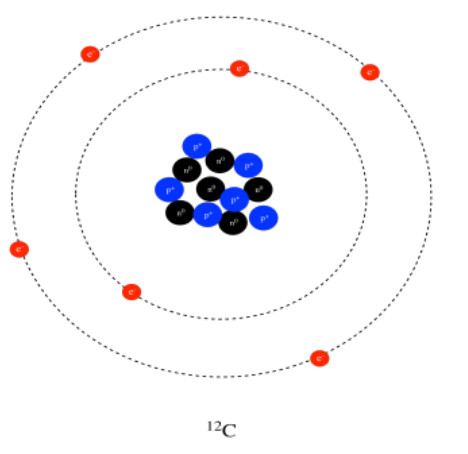
Algunos átomos de carbono tienen un neutrón extra o dos, por lo que el carbono puede tener un peso atómico de 13 o incluso 14 amu. Sin embargo, un átomo de carbono no puede tener un protón extra; un protón extra lo convertiría en un átomo de nitrógeno. Son los seis protones los que hacen que el átomo se comporte como carbono. Muchos otros elementos pueden tener pesos atómicos ligeramente diferentes, dependiendo de cuántos neutrones se encuentren en el núcleo. Diferentes átomos del mismo elemento con diferentes pesos se denominan isótopos. Por ejemplo, 12 C, 13 C y 14 C son todos isótopos de carbono. Todos ellos tienen seis protones, pero diferentes números de neutrones, como se ve en un modelo de 12 C y 13 C, a continuación.
- Los neutrones también están en el núcleo.
- Un neutrón tiene una masa similar a un protón, pero no tiene carga.
- En comparación con los protones y neutrones, la masa de un electrón es muy pequeña.
El número atómico de un elemento es solo el número de protones en un átomo de ese elemento. Dados los siguientes números atómicos y pesos atómicos, identificar el número de protones, neutrones y electrones en un átomo del elemento.
- oxígeno: número atómico = 8, peso atómico = 16
- fósforo: número atómico = 15, peso atómico = 31
- zinc: número atómico = 30, peso atómico = 65
- oro: número atómico = 79, peso atómico = 197
- Respuesta a:
-
O: 8 protones, 8 electrones, 8 neutrones
El átomo es neutro en general, por lo que el número de protones cargados positivamente es igual al número de electrones cargados negativamente. El peso atómico es proporcionado casi en su totalidad por los protones y neutrones, por lo que el número de protones más el número de neutrones es igual al peso atómico.
- Respuesta b:
-
P: 15 protones, 15 electrones, 16 neutrones
- Respuesta c:
-
Zn: 30 protones, 30 electrones, 35 neutrones
- Respuesta d:
-
Au: 79 protones, 79 electrones, 118 neutrones
Si la masa de un protón es de 1.67 x 10 -27 kg y la masa de un electrón es de 9.11 x 10 -31 kg, ¿cuántas veces más pesado es un protón que un electrón?
Si el carbono en la naturaleza es aproximadamente 99% 12 C y 1% 13 C, entonces ¿cuál es el peso promedio de un átomo de carbono?
- Contestar
-
Carbono: [(99 x 12 amu) + (1 x 13 amu)]/100 = [1,188 + 13 amu]/100 = 1,201 amu/100 = 12.01 amu
Tenga en cuenta que 14 C es incluso más raro que 13 C, porque 14 C se convierte en 14 N mediante desintegración radiactiva. En ese caso, se emite un electrón de alta energía desde el núcleo de 14 C. Explique cómo esa emisión debe convertir el carbono en nitrógeno, e indicar cuántos protones y neutrones se encuentran en el núcleo resultante.
- Contestar
-
La salida del electrón cargado negativamente del núcleo deja atrás una carga positiva. Un neutrón se convierte en un protón. El peso atómico global sigue siendo el mismo, pero el átomo termina con un protón más y un electrón más. Un 14 C se convierte en un 14 N.
El magnesio en la naturaleza se encuentra en tres isótopos principales. Es casi 79% 24 Mg, alrededor de 11% 25 Mg y 12% 26 Mg. ¿Cuál es el peso promedio de un átomo de magnesio?
El cloro en la naturaleza se encuentra en dos isótopos principales: 35 Cl y 37 Cl. Si el peso atómico promedio del cloro es de aproximadamente 35.5, ¿qué porcentaje de cada isótopo se encuentra en la naturaleza?
- Contestar
-
Supongamos que y es la fracción decimal de 35 Cl y z es la fracción decimal de 37 Cl.
35.5 amu = (y x 35 amu + z x 37 amu) /100 pero y + z = 1
35.5 amu = (y x 35 amu + (1-y) x 37 amu)
35.5 amu = y x 35 amu - y x 37 amu + 37 amu
(37-35) x y amu = 37 amu - 35.5 amu
2 x y amu = 1.5 amu
y = 0.75 (75% 35 Cl)
z = 0.25 (25% 37 Cl)
Una serie de desarrollos a principios del siglo XX llevaron a nuestra comprensión actual de la estructura de los átomos y moléculas cien años después. En ese momento, algunas personas aunque protones, neutrones y electrones estaban agrupados en el átomo. Esta visión del átomo se llamó el “modelo de pudín” del átomo.
Ernest Rutherford propuso por primera vez que un átomo contiene un núcleo muy pequeño, cargado positivamente, rodeado de espacio vacío. Los electrones orbitaban lejos del núcleo.

Rutherford estaba explicando el resultado de un experimento en el que partículas alfa (iones de helio cargados positivamente) se dispararon contra una lámina de oro. La mayoría de estas partículas pasaban a través de la lámina fácilmente, lo que sugiere que había mucho espacio vacío en el material. Sin embargo, algunas de las partículas rebotaron directamente hacia atrás, habiendo colisionado con los núcleos pequeños y altamente cargados. Las partículas alfa positivas fueron repelidas poderosamente por los núcleos positivos, porque cargas similares se repelen entre sí. Realmente no sabía mucho sobre la ubicación de los electrones, las partículas cargadas negativamente en el átomo, pero creía que orbitaban el núcleo como planetas alrededor del sol.
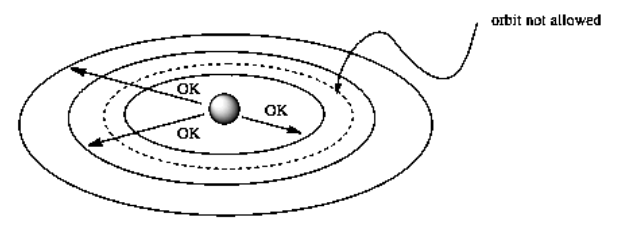
¿Por qué no se encontraron los electrones en el núcleo? Si los electrones son atraídos por los protones, parece que ahí es donde deberían estar. Niels Bohr sugirió que los electrones se encuentran solo en órbitas específicas permitidas a diferentes distancias del núcleo.
Ese salto conceptual a órbitas específicas, permitidas marca la introducción de la mecánica cuántica en la comprensión del átomo. La mecánica cuántica se basa en la idea de que a una escala muy pequeña, muchas propiedades solo tienen valores específicos (como 1, 2, 3...) en lugar de cualquier valor en absoluto (como todas las fracciones posibles entre estos enteros). Es decir, en el mundo que nos rodea, solemos ver cosas como subir por una rampa. Podemos calentar una olla de agua un poco más caliente, y solo un poco más cálida que eso, y así sucesivamente. En la escala atómica, sin embargo, el mundo se parece más a subir un conjunto de escaleras. A lo mejor podrías calentar el agua a 30 o C o 40 o C, pero calentar a 35 o C sería imposible, porque el calor solo viene en paquetes de 10 grados. Así es, de hecho, cómo funciona realmente el mundo cuántico, pero a escala humana, los pasos involucrados son tan pequeños que no podemos notarlos.
El modelo de Bohr también fue consistente con la idea anterior de la tabla periódica de los elementos. La idea es que los electrones se encuentran en diferentes “conchas” que están cada vez más lejos del núcleo. Cada uno de esos shells corresponde aproximadamente a una fila diferente en la tabla periódica. El hidrógeno y el helio tienen electrones solo en la primera capa, y vemos esos dos elementos en la primera fila de la tabla periódica. Los electrones más externos del carbono y el oxígeno se encuentran en la segunda capa, por lo que aparecen en la segunda fila de la tabla periódica.
Cada fila de la tabla periódica corresponde a una capa externa de electrones que se encuentran más lejos del núcleo que los electrones más externos de la fila anterior a él. Vamos a ver con el tiempo que hay una variación adicional de esta idea, pero sigue siendo prácticamente la forma en que vemos la tabla periódica hoy en día. El hidrógeno inicia la primera cáscara, el litio el segundo, el sodio (el latín, el sodio) el tercero, el potasio (latín, kalium) el cuarto, y así sucesivamente.
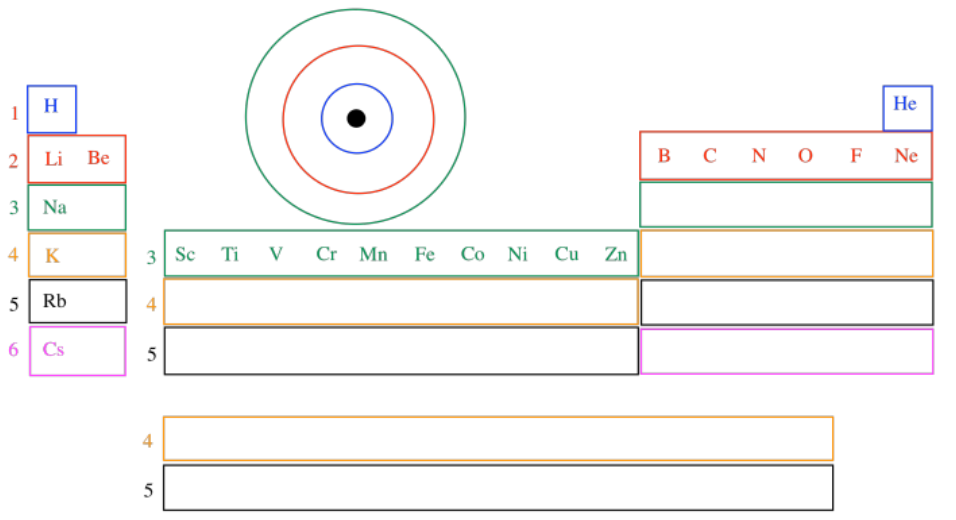
La variación que vamos a ver implica esa inmersión en medio de la tabla periódica. El escandio a través del zinc tienen electrones externos que solo están en la tercera capa, no en la cuarta. El tercer y el cuarto caparazón se superponen un poco, de manera que algunos electrones realmente comienzan a entrar en la cuarta capa (como en potasio y calcio), luego terminan de llenar la tercera capa a través de los metales de transición. Las razones de eso también tienen que ver con la mecánica cuántica, pero tendremos que aprender un poco más sobre la energía y las olas antes de ver por qué.
Bohr demostró que los electrones podrían encontrarse en órbitas específicas alrededor del núcleo. También demostró que los electrones en estas diferentes órbitas tienen cantidades específicas de energía. Al hacer esto matemáticamente, estaba ofreciendo una explicación a un problema importante. La gente sabía que los átomos pueden absorber energía (se pueden calentar en una llama, por ejemplo) y devolver la energía nuevamente en forma de luz. En lugar de desprender luz de todos los colores cuando se excitan, los átomos solo desprenden colores muy específicos. Por ejemplo, calentar sales de litio en una llama produce un color rojo, pero calentar las sales de sodio produce un color naranja, mientras que las sales de potasio producen un color púrpura, y así sucesivamente.
Estos colores se pueden separar y estudiar usando un prisma. Cuando la gente hacía eso, encontraron que un átomo dado no produce solo un color puro de luz, sino varios diferentes. Cuando se separa por un prisma, la luz desprendida por un compuesto excitado podría verse contra una superficie oscura como varias líneas de colores diferentes. A estas se les llamó líneas de emisión.
Se sabía desde principios de 1800 que la luz tenía propiedades de onda, y que la luz de diferentes colores tenía diferentes longitudes de onda. Por ejemplo, la luz roja consiste en ondas electromagnéticas, con una longitud de onda de aproximadamente 700 nm, pero la longitud de onda de la luz azul es de aproximadamente 450 nm. Eso significa que un color en realidad se puede medir numéricamente. Debido a ese hecho, las personas pueden buscar relaciones matemáticas entre las líneas de emisión observadas para diferentes átomos. Esas relaciones matemáticas pueden revelar algo sobre los átomos mismos.
Además, se sabía que diferentes longitudes de onda de luz correspondían a diferentes cantidades de energía. En uno de los primeros desarrollos en mecánica cuántica, Max Planck en 1900 propuso que la luz viaja en haces llamados fotones. Aunque son partículas, estos fotones sí tienen propiedades de onda. La cantidad de energía en un fotón de luz corresponde a su longitud de onda.
Al proponer que los electrones solo se podían encontrar en órbitas específicas, a distancias específicas del núcleo, Bohr estaba tratando de explicar observaciones de espectroscopia atómica reportadas por otro científico llamado Rydberg. Rydberg había encontrado una relación matemática entre las longitudes de onda de estas líneas de emisión. Bohr pensó que, cuando se agregaba energía, los electrones podían excitarse de un nivel de energía (u órbita) a uno superior. Cuando el electrón se relajó de nuevo a su órbita original, desprendió la energía que había ganado en forma de luz. Las líneas de emisión específicas ocurren porque los electrones se encuentran a niveles de energía muy específicos en un átomo, por lo que una caída de un nivel a otro siempre produce la misma cantidad de energía luminosa. Esa cantidad específica de energía luminosa tiene un color específico.
Bohr luego utilizó las relaciones matemáticas que describen la atracción electrostática y la fuerza centrípeta para demostrar que su modelo del átomo era consistente con la relación de Rydberg. De hecho, podría utilizar su modelo para predecir las líneas de emisión de un átomo.
La explicación de Bohr de la estructura atómica basada en la observación de Rydberg de una serie numérica en líneas de emisión espectral. Resolver una serie implica encontrar un patrón en números. Encuentre los patrones entre las siguientes secuencias de números y prediga el siguiente número en la secuencia.
- 1, 2, 3, 4...
- 2, 4, 6, 8...
- 3, 5, 7, 9...
- 1, 4, 9, 16...
- 2, 4, 8, 16...
- 1, 1/2, 1/4, 1/9...
- Respuesta a:
-
1, 2, 3, 4, 5... una serie de números enteros, o n.
- Respuesta b:
-
2, 4, 6, 8, 10... una serie de números pares, o 2n (porque cada número par es dos veces otro número).
- Respuesta c:
-
3, 5, 7, 9, 11... una serie de números impares, o 2n + 1 (porque cada número impar es uno más que algún número par).
- Respuesta d:
-
1, 4, 9, 16, 25... una serie de cuadrados, o n 2.
- Respuesta e:
-
2, 4, 8, 16, 32... una serie en la que cada número es el doble del último número, o 2 n.
- Respuesta f:
-
1, 1/2, 1/4, 1/9, 1/16... una serie de recíprocos de cuadrados, o 1/n 2.
La idea de Bohr dependía en parte del uso de la Ley de atracción electrostática de Coulomb. La ley de Coulomb se expresa matemáticamente de la siguiente manera:
\[F = \frac{kq_{1}q_{2}}{r^{2}}\]
en la que F es la fuerza de atracción entre dos partículas cargadas, q 1 y q 2 son las cargas sobre las dos partículas, r es la distancia entre las dos partículas y k es una constante. Un gran valor de F significa que los cargos son fuertemente atraídos entre sí.
- Supongamos q 1 es la carga en el núcleo de un átomo y q 2 es la carga sobre un electrón. ¿Qué sucede con la fuerza de atracción entre un electrón y el núcleo cuando aumenta la carga en el núcleo? Explique.
- Supongamos que r es la distancia desde el electrón hasta el núcleo. ¿Qué sucede con la fuerza de atracción entre un electrón y un núcleo cuando el electrón se aleja del núcleo?
- Utilizando las ideas de la ley de Coulomb, compare la atracción de un electrón al núcleo en un átomo de helio frente a un átomo de hidrógeno.
- Respuesta a:
-
Cuando q aumenta, F aumenta. El incremento es lineal: si q 1 dobla, F duplica. A medida que la carga en el núcleo se hace más grande, la fuerza de atracción se hace más grande.
- Respuesta b:
-
Cuando r aumenta, F disminuye. La disminución es no lineal: si r se duplica, F cae en un factor de cuatro, en lugar de un factor de dos. A medida que la distancia desde el núcleo se alarga, la atracción hacia el núcleo disminuye bruscamente.
- Respuesta c:
-
El hidrógeno y el helio están ambos en la primera fila de la tabla periódica. A una aproximación aproximada, la distancia entre núcleo y electrón es similar en estos dos átomos. Sin embargo, el helio tiene una carga de 2+ en sus núcleos, en comparación con la carga 1+ en el núcleo de un átomo de hidrógeno. En consecuencia, la atracción de un electrón sobre el helio hacia el núcleo sería aproximadamente el doble de grande que la atracción de un electrón sobre el hidrógeno hacia su núcleo.
Los electrones del helio están mucho más apretados que los de hidrógeno.
La situación es realmente mucho más complicada que eso. Por ejemplo, si los electrones del helio son más fuertemente atraídos hacia el núcleo que los del hidrógeno, entonces los electrones del helio deberían ser arrastrados más cerca del núcleo que los del hidrógeno. Eso significa que los electrones del helio se mantienen aún más apretados de lo que pensábamos al principio.
Otro factor que complica es que el helio tiene dos electrones, mientras que el hidrógeno solo tiene uno. Un electrón puede ser atraído hacia el núcleo, pero los electrones se repelen entre sí. Ese segundo electrón en el helio debería compensar la atracción adicional hacia el núcleo más positivo del helio. Eso significa que los electrones del helio pueden ser menos atraídos de lo que pensábamos originalmente.
Sin embargo, el efecto del segundo electrón es mucho menor de lo que aparece primero. Eso es porque el segundo electrón podría estar en cualquier parte alrededor del átomo de helio. Tiene un 50% de probabilidad de estar más lejos del primer electrón que ese núcleo cargado positivamente. Cuanto más lejos está, menor es su influencia. Los electrones del helio son definitivamente más fuertemente atraídos por el núcleo que los del hidrógeno, pero es difícil decir exactamente cuánto más sin la ayuda de algunas herramientas más sofisticadas.
Max Planck describió la energía de un fotón usando la siguiente relación:
\[E = h \nu \) or E = \frac{hc}{\lambda} \nonumber\]
En el que E = energía; ν =frecuencia; λ = longitud de onda; c = velocidad de la luz; h = constante de Planck
- ¿Qué pasa con la energía de la luz a medida que su longitud de onda se alarga
- ¿Qué pasa con la energía de la luz a medida que aumenta su frecuencia?
- Respuesta a:
-
Cuando la longitud de onda se alarga (el valor de λ aumenta), la energía disminuye.
- Respuesta b:
-
A medida que la frecuencia aumenta (el valor de ν aumenta), la energía aumenta.
Otras personas estaban familiarizadas con estas ideas y ya conocían la relación entre la luz y la energía. El modelo de los átomos de Bohr puso todas estas ideas juntas para explicar con éxito una propiedad atómica específica:
color = longitud de onda = energía de la luz = energía entre niveles de electrones.
En otras palabras, un electrón excitado puede caer de nuevo a su órbita original emitiendo un fotón con una energía exactamente igual a la diferencia de energía entre las dos órbitas (órbitas de “estado excitado” y “estado fundamental”).

Sin embargo, Bohr no explicó por qué los electrones se encontrarían en niveles específicos de energía en primer lugar. Louis de Broglie, historiador convertido en físico, resolvió este problema con la idea de la dualidad onda-partícula. De Broglie armó las siguientes ideas:
- Todas las partículas móviles tienen propiedades de onda.
- Los electrones se mueven alrededor del núcleo y tienen longitudes de onda.
- Para mantener una onda estacionaria completa a lo largo de su órbita, un electrón solo puede adoptar órbitas de circunferencias específicas. De lo contrario, un extremo de la ola no se encontraría con el otro extremo, e interferiría consigo mismo.
- Las órbitas con circunferencias específicas tienen radios específicos.
- Los electrones se encuentran a distancias específicas del núcleo, pero no a otras distancias.
Una forma de ilustrar por qué un electrón podría tener solo ciertas órbitas permitidas es a través de la “partícula en una caja”, un concepto básico de la mecánica cuántica. Si una partícula tiene propiedades de onda, entonces tiene una longitud de onda. Su longitud de onda depende de ciertas condiciones. Por analogía, si tomas una cuerda de guitarra y la colocas a los extremos de una caja, la cuerda solo puede vibrar a ciertas frecuencias. Así es como los guitarristas pueden cambiar la nota tocada en una cuerda de guitarra. Al presionar un extremo de la cuerda contra un traste en el mástil de la guitarra, se cambia la longitud de la cuerda, y también lo es su longitud de onda permitida, por lo que hace un sonido diferente.
La cuerda no puede moverse en los dos puntos donde se sostiene. Eso significa que la ola tiene que formarse de tal manera que vuelva a la misma posición en ambos extremos. Debido a eso, ciertas longitudes de onda no funcionarán, porque la onda no podrá regresar a esa posición correcta en el extremo más alejado.
Además, las longitudes de onda permitidas de una cuerda de guitarra también dependen del grosor de la cuerda. En consecuencia, hay dos condiciones que controlan el tono que se toca: cuál de las seis cuerdas de guitarra está arrancada, y dónde se sujeta la cuerda contra los trastes.
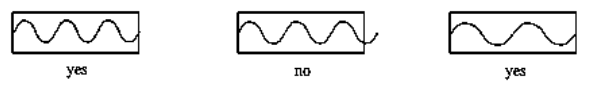
Lo mismo ocurre con partículas muy pequeñas que tienen propiedades de onda. Estas partículas solo pueden tener ciertas longitudes de onda que se ajusten a su entorno. Un electrón tiene alguna propiedad, análoga al grosor de una cuerda de guitarra, que limita sus posibles longitudes de onda. Dados esos límites, sólo hay ciertas órbitas permitidas al electrón. Si su órbita no tiene la circunferencia correcta, el electrón no podrá formar una onda completa a lo largo de esa órbita.
Estas ideas marcaron el paso de una revolución en la ciencia. La mecánica cuántica es una herramienta muy poderosa. Se puede utilizar para predecir con precisión cómo se comportarán las moléculas. Desafortunadamente, las matemáticas involucradas en la mecánica cuántica son uno o dos cursos de matemáticas más allá de lo que la mayoría de los estudiantes de química introductoria conocen. Aun así, una sensación cualitativa de algunas de las consecuencias de la mecánica cuántica es lo suficientemente importante como para que debamos explorarla.
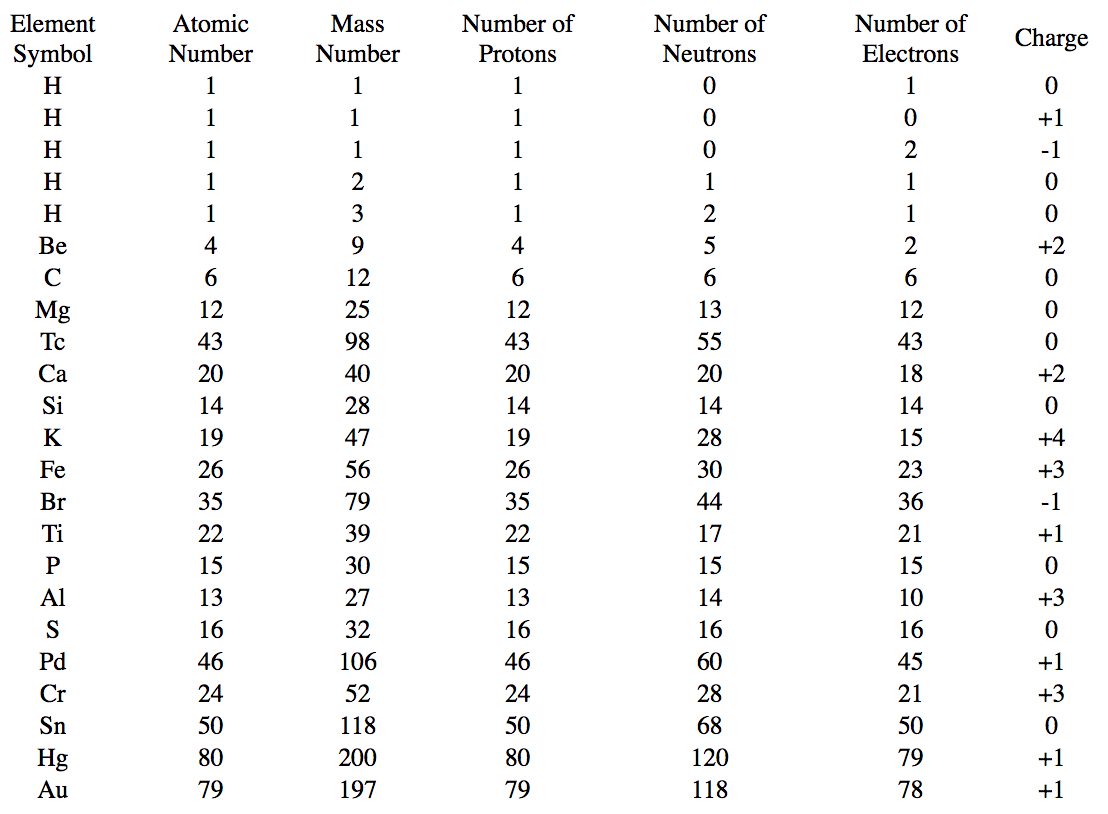
Completar la tabla con la información correspondiente.
| Símbolo de elemento | Número atómico | Número Masivo | Número de protones | Número de Neutrones | Número de electrones | Cargar |
|---|---|---|---|---|---|---|
| H | 1 | 1 | ||||
| H | 1 | 0 | ||||
| H | 1 | 2 | ||||
| H | 2 | 1 | ||||
| H | 3 | 1 | ||||
| 4 | 9 | 2 | +2 | |||
| 6 | 12 | 6 | 6 | |||
| 12 | 13 | 12 | 0 | |||
| 43 | 55 | 43 | ||||
| 20 | 40 | +2 | ||||
| Si | 14 | 28 | 0 | |||
| 19 | 28 | +4 | ||||
| Fe | 26 | 30 | 23 | |||
| 35 | 44 | -1 | ||||
| K | 22 | 17 | 21 | |||
| 15 | 15 | 0 | ||||
| 13 | 27 | +3 | ||||
| S | 16 | 16 | 0 | |||
| Pd | 106 | 46 | +1 | |||
| 24 | 28 | 21 | ||||
| 50 | 68 | 50 | ||||
| Hg | 80 | 120 | 79 | |||
| 79 | 118 | 78 |
- Contestar
-