2.1: Introducción a los Metales
- Page ID
- 80697
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La mayoría de los elementos que se encuentran en la tierra son metales. Una mirada a la tabla periódica muestra que estos elementos ocupan todo el tramo izquierdo de la tabla, desde el grupo principal, pasando por los metales de transición, lantánidos, actínidos, elementos alcalinos y alcalinotérreos.

Un elemento incluido aquí, el hidrógeno, rara vez se clasifica como metal. En la tierra, el hidrógeno es un gas, y generalmente se clasifica como un no metal, como el oxígeno y el nitrógeno. Sin embargo, a temperaturas muy bajas y presiones muy altas, el hidrógeno es un sólido, y en las condiciones adecuadas se espera que se comporte más como un metal. Se piensa que los gigantes gaseosos, como Júpiter y Saturno en nuestro sistema solar, pueden tener núcleos metálicos de hidrógeno.
Los elementos metálicos no se encuentran generalmente como átomos individuales. En cambio, los átomos en un elemento como el hierro se agrupan para formar una estructura más grande. Los materiales formados de esta manera tienen algunas propiedades similares. Los metales son brillantes. Los metales son maleables; pueden doblarse y formarse en diferentes formas (al menos cuando se calientan). Los metales son buenos conductores de electricidad.
- En los metales, grandes grupos de átomos se agrupan.
- Los átomos metálicos forman grandes matrices extendidas, y los átomos se repiten en patrones específicos a lo largo del sólido.
Las propiedades de los metales son realmente importantes. El hecho de que los metales sean maleables permite que sean conformados en láminas que pueden ser utilizadas para fabricar automóviles, aviones, líneas ferroviarias, contenedores de carga y barcos, así como artículos más delicados como joyas y herramientas quirúrgicas. Una propiedad relacionada, la ductilidad, permite que los metales se estiren en alambres largos y delgados. Junto con la conductividad de los metales, esta propiedad permite que las líneas de transmisión lleven electricidad desde estaciones generadoras hasta personas como usted. A veces, la fuente de electricidad está a cientos de kilómetros de distancia; la electricidad utilizada para alimentar una computadora portátil en Nueva York puede provenir de lugares como La Grande Baleine o James Bay, en el noroeste de Quebec.
Algunas de estas propiedades se pueden entender pensando en la estructura de los elementos metálicos. Gran parte de nuestro conocimiento estructural de los metales y otros materiales proviene de estudios de difracción de rayos X. Un haz muy enfocado de rayos X puede ser enviado a un material, donde rebotarán en los átomos y se dispersarán en diferentes direcciones. El resultado suena caótico, pero si el sólido está altamente organizado, los rayos X se comportan de maneras muy predecibles. El resultado es un patrón de difracción de rayos X. Un patrón de difracción es un poco como el patrón de ondas en un estanque cuando una piedra es arrojada a aguas tranquilas. El patrón se puede estudiar y decodificar matemáticamente para encontrar las ubicaciones de los átomos dentro del material.
- La difracción de rayos X puede revelar las estructuras de nivel atómico de materiales altamente ordenados como los metales.
¿Qué nos dice la difracción de rayos X? Evidentemente, un trozo de metal no es solo una masa de átomos pegados al azar. En cambio, los átomos se disponen en capas ordenadas de maneras muy específicas. Estas capas de átomos se asientan una encima de la otra para formar un sólido tridimensional.

Una de las propiedades que resulta de esta disposición organizada de los átomos es la maleabilidad de los metales. Si tomas un metal agradable y blando como el cobre, después de recocerlo en un fuego u horno, se puede doblar y moldear fácilmente. Con cobre, esto se puede hacer incluso después de que el metal se haya enfriado a temperatura ambiente. Cuando doblas el cobre, en realidad estás haciendo que capas de átomos se deslicen una sobre la otra, hasta que dejes de doblarte y lleguen a descansar en una nueva ubicación.

Si alguna vez has hecho esto, sabrás que cuanto más trabajes con el cobre, más difícil es doblarlo. Eso es porque mientras estás deslizando capas de átomos hacia adelante y hacia atrás, ocasionalmente un átomo (o una fila entera de átomos) se desliza fuera de lugar. Ya no forma parte de una capa lisa, por lo que otros átomos no pueden deslizarse más allá de ella tan fácilmente. A esta situación se le llama defecto. Una vez que hay suficientes defectos en el metal, es imposible doblar más el material.
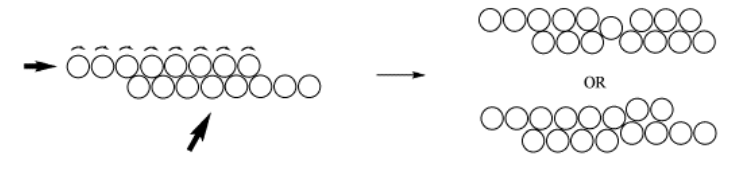
- Los átomos metálicos se encuentran en capas organizadas.
- Debido a que estas capas pueden rodar unas sobre otras, los metales se pueden trabajar en diferentes formas.
Una aleación es una mezcla de dos metales. El acero es una aleación de hierro con cualquiera de una serie de otros elementos, como cromo o vanadio. Las aleaciones suelen ser más duras que los metales compuestos por un elemento puro. Muestra cómo la aleación introduce un defecto en el metal y cómo eso hace que el metal sea más fuerte.
- Contestar
-
El segundo átomo de metal es de un tamaño diferente al átomo de metal principal. No encajará del todo en la matriz de átomos. En consecuencia, los átomos no podrán deslizarse uno junto al otro con la misma facilidad.
¿Qué es lo que mantiene unidos estos átomos metálicos? Para responder a esa pregunta, es importante darse cuenta dónde se encuentran los materiales metálicos en la tabla periódica. La parte inferior izquierda de la tabla periódica es donde se encuentran los menos elementos electronegativos. De hecho, todos estos elementos pierden electrones fácilmente, y frecuentemente se encuentran como cationes en compuestos naturales. Por ejemplo, la hematita es un mineral de hierro común, que contiene cationes de hierro (Fe 3 +) y aniones de oxígeno (O 2-). La fórmula de este compuesto es Fe 2 O 3, lo que significa que siempre hay una relación de tres aniones de oxígeno por cada dos cationes de hierro en la hematita.
Mostrar cómo la proporción de elementos en hematites conduce a un compuesto de carga equilibrada (neutro general).
- Contestar
-
2 Fe: (3 +) x 2 = (6 +)
3 O: (2 -) x 3 = (6 -)
Fe 2 O 3: neutro
Muchos de los átomos en un material metálico están presentes como cationes. Pero, ¿a dónde fueron sus electrones perdidos? Bueno, esos electrones siguen en el material, moviéndose entre los átomos de hierro y los cationes. En una pieza de hierro, la atracción entre los cationes de hierro y los electrones que se mueven libremente ayuda a mantener el metal unido. Esta forma de pensar sobre los metales a veces se llama el modelo de unión del “mar de electrones”.
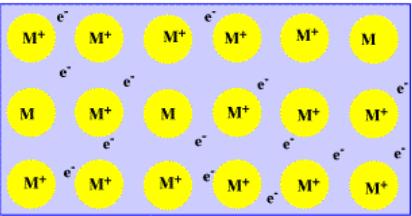
- La unión en metales a menudo se describe a través del “modelo de mar de electrones”.
- Los iones metálicos están rodeados por electrones deslocalizados.
- Los electrones deslocalizados no están restringidos a un átomo u otro; se distribuyen a través de varios átomos en el sólido.
¿Por qué los metales conducen la electricidad? La electricidad es el movimiento de electrones a través de un material. Pero la conducción de corriente a través de un metal probablemente tiene lugar a través de una serie de eventos. Si se introduce un electrón en un extremo del material, probablemente será atraído por un catión metálico. Incluso puede ser capturado por ese metal. A veces, describimos este electrón como moviéndose hacia un “agujero”; un agujero, en términos de conductividad, es solo una carga positiva que captura un electrón. Pero recuerda que los metales siguen siendo bastante electropositivos (lo contrario de electronegativo), y es probable que ese átomo metálico pierda otro electrón. Este puede no ser el mismo electrón que el que pones; probablemente sea otro. Ese electrón a su vez puede ser capturado por otro agujero en otro metal. Ese metal puede perder otro electrón, y así sucesivamente. Los electrones saltarán y saltarán de un metal a otro en todo el material. Se produce una corriente eléctrica porque estos electrones saltando en el metal se alejan de los electrones que se están suministrando en un extremo. Se mueven hacia el otro extremo, en cambio.

El brillo de los metales también se atribuye al aspecto electrón-mar de la unión metálica. Las colisiones entre los fotones entrantes y los electrones “libres” en la superficie de un metal hacen que los fotones reboten en la superficie. El color rojizo del cobre resulta de un límite en las longitudes de onda de la luz visible que rebota en el metal.
- El modelo de mar electrónico se utiliza para explicar varias propiedades únicas de los metales.
Hasta el momento, hemos mirado el modelo de mar de electrones puramente en términos de electrostática: el electrón cargado negativamente es atraído hacia el núcleo cargado positivamente. Sin embargo, ya vimos en la discusión de la mecánica cuántica en el átomo que la energía cinética y la longitud de onda del electrón también es un factor importante en la química.

Supongamos que las siguientes cajas están medio llenas de agua. Mostrar la longitud de onda más larga posible en cada una de las cajas.
- Contestar
-
Cuanto más larga sea la caja, mayor será la longitud de onda posible.
En el modelo de mar de electrones de unión metálica, los electrones pueden ser deslocalizados. Ya no están confinados a un solo átomo, sino que pueden extenderse sobre múltiples átomos. Como resultado, la longitud de onda del electrón aumenta. Porque la longitud de onda es inversamente proporcional a la energía, a medida que aumenta la longitud de onda de un electrón, su energía disminuye Como resultado, la dispersión de electrones sobre un grupo de metales resulta en una disminución de la energía debido a las propiedades de onda de los electrones.
- La deslocalización es un concepto importante en química.
- La deslocalización está relacionada con el concepto de “partícula en una caja”: cuanto más largo sea el contenedor, mayor será la longitud de onda posible.
- Al extenderse sobre un grupo más grande de átomos, un electrón puede adoptar una longitud de onda más larga.
- Un electrón con una longitud de onda más larga tiene una energía menor.
Algunas de las propiedades de los metales se pueden entender, dado un esquema básico de la estructura de un metal. Vamos a ver con más detalle exactamente cómo los átomos metálicos se disponen en sólidos, antes de ver algunas de las formas en que los metales forman compuestos con otros elementos.

