2.2: Una capa de átomos metálicos
- Page ID
- 80693
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Los metales están compuestos por átomos en capas ordenadas. Estos átomos forman una estructura cristalina tridimensional. Eso significa que las unidades individuales dentro del sólido —los átomos, en este caso— están organizadas en un patrón que se repite regularmente, como las estrellas en la bandera estadounidense.
Las cosas tridimensionales pueden ser difíciles de pensar. Es mucho más fácil comenzar en dos dimensiones. En esta página, vamos a ver un par de formas en que los átomos metálicos podrían organizarse en una sola capa. Vamos a construir a partir de ahí más adelante. Mientras tanto, intentaremos familiarizarnos con una serie de términos que se utilizan para describir estructuras cristalinas.
Cuadrados Simples
Vivimos en una sociedad cartesiana. Nuestras casas y edificios son en su mayoría cuadrados, nuestras habitaciones son cuadradas, nuestras calles son rectas y se encuentran en ángulo recto, a menos que vivamos en un lugar serpenteante sobre el agua, como Boston o Venecia. Probablemente sea más fácil imaginar capas de átomos que forman bonitos cuadrados.
Supongamos que un grupo de átomos forma una bonita línea recta. Otro grupo forma una segunda línea, y cada átomo de la segunda línea se asienta directamente detrás de un átomo en la primera línea. Una tercera fila se forma de la misma manera. La capa resultante tiene filas y columnas ordenadas de átomos. El patrón de átomos se repite regularmente a medida que miras de derecha a izquierda, y como miras de adelante hacia atrás.
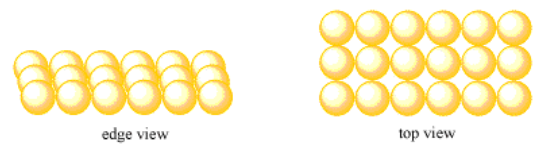
Llamaremos a este tipo de capa una simple capa cuadrada.
- En una capa cuadrada, los átomos están dispuestos en filas y columnas.
Capas hexagonales
Algunos átomos de metales pueden estar dispuestos en capas cuadradas simples. Otros adoptan un arreglo ligeramente diferente.
Comienza con la misma línea ordenada de átomos en la primera fila. Esta vez, cuando se forme la segunda fila de átomos, no los pondremos directamente detrás de los átomos de la primera fila. Los pondremos justo entre los átomos de enfrente. Cada átomo de la segunda fila se sienta detrás de dos átomos en la primera fila, como si estuviera asomándose entre ellos, como niños en una foto de clase de jardín de infantes (antes de que todos se retuerzan).
La tercera fila también estará ligeramente desplazada de la fila que tiene delante. Si miras con atención, puedes ver que pone a cada uno de los átomos de la tercera fila directamente detrás de un átomo en la primera fila, pero una fila extra más lejos. La cuarta fila estará ligeramente compensada con respecto a la tercera, y así sucesivamente.
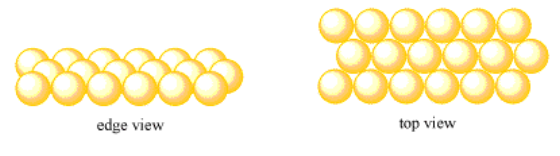
Todavía tenemos una estructura cristalina. Hay un patrón que se repite regularmente mientras miramos de izquierda a derecha. También hay un patrón repetitivo a medida que nos movemos de adelante hacia atrás, pero ahora ese patrón se repite cada dos filas, en lugar de cada fila.
Este tipo de capa se llama capa hexagonal. A veces, se le llama una capa muy empaquetada.
- En una capa hexagonal, las filas están compensadas entre sí por medio átomo.
- Cada átomo en una capa hexagonal está rodeado por otros seis átomos.
- Mira la capa cuadrada simple. ¿Puedes encontrar patrones repetitivos en otras direcciones (en lugar de izquierda-derecha o delantera-atrás)? Si es así, ¿en qué dirección?
- Mira la capa hexagonal. ¿Puedes encontrar patrones repetitivos en otras direcciones (en lugar de izquierda-derecha o delantera-atrás)? Si es así, ¿en qué dirección?
- Respuesta a:
-
El patrón también se repite diagonalmente.
- Respuesta b:
-
El patrón también se repite diagonalmente.
Normalmente pensamos en los átomos como pequeñas esferas, o círculos si estamos trabajando en sólo dos dimensiones. ¿Cómo podrían otras formas formar una capa organizada? Dibuja una capa organizada para cada una de las siguientes formas, usando alrededor de una docena de unidades en cada caso.
- cuadrados.
- triángulos (equiláteros: todos los lados de la misma longitud).
- hexágonos.
- pentágonos.
En cada caso, ¿solo hay una manera de empacar las formas de manera regular? ¿Puedes encontrar patrones repetitivos en la capa? Si es así, ¿en qué dirección?
¿Hay alguna forma que pareciera más difícil de arreglar en una capa repetitiva?
- Contestar
-
Los cuadrados pueden formar una serie de patrones que se repiten regularmente. Las filas pueden repetirse exactamente (un patrón aaa), o se pueden desplazar ligeramente, de modo que cada dos filas repitan exactamente la primera fila (un patrón ababab). Incluso podrían ser desplazados para que cada tercera fila sea una repetición exacta de la primera (abcabcabc).
Los pentágonos no forman una capa repetitiva en dos dimensiones.
Agujeros
A diferencia de otras formas geométricas, los círculos no se empaquetan sin espacio entre ellos. Los espacios entre los átomos dentro de una capa se denominan agujeros. Tenga en cuenta que el uso de la palabra “agujeros” aquí no tiene nada que ver con agujeros en la conductividad-habla. En esta página, los agujeros son solo espacios entre átomos. En conductividad, los agujeros son lugares donde hay carga positiva que podría capturar un electrón.
En ocasiones, los espacios entre los átomos se describen de otras maneras, como los “sitios intersticiales”.
Posteriormente, estos sitios intersticiales o agujeros serán importantes en la construcción de compuestos a partir de mezclas de elementos. Verás que los espacios vacíos en una matriz de átomos dejan espacio para que un segundo tipo de átomo se embale en la misma estructura.
Los agujeros generalmente tienen formas particulares. Las formas varían, dependiendo de cómo estén dispuestos los átomos. Por ejemplo, ¿cómo describiría la forma de los agujeros en las siguientes capas?
- empaque cuadrado simple.
- empaque hexagonal o cerrado.
- Respuesta a:
-
En el empaque cuadrado simple, los agujeros tienen forma aproximada de diamante.
- Respuesta b:
-
En el patrón hexagonal, los agujeros son aproximadamente triangulares.
Puedes encontrar una respuesta mirando un dibujo, o puedes intentar empacar una capa de diez centavos o centavos o cuartos (siempre que sean todos iguales) y mirar los espacios entre ellos
Celdas unitarias
La unidad repetitiva más simple en un patrón a veces se llama celda unitaria. En una capa, la celda unitaria se puede rastrear una y otra vez sobre la capa, de modo que se tenga en cuenta cada parte de la capa (pero dependiendo de dónde empieces a trazar, podrías quedarte sin espacio en los bordes).

Debido a que cada capa está compuesta por átomos individuales, podríamos llamar a un solo átomo la celda unitaria. Sin embargo, también utilizamos la celda unitaria para ilustrar la relación espacial entre los átomos en la capa. Por esa razón, a menudo cambiamos la celda unitaria para mostrar múltiples átomos.
Por ejemplo, en una fila de átomos, una celda unitaria podría ser un cuadrado. Los extremos del cuadrado cortarían a través de dos átomos vecinos. La celda unitaria contiene dos medios átomos, para un total de un átomo. El cuadrado podría repetirse en línea recta para reproducir la fila de átomos.
- La celda unitaria es la unidad repetitiva más pequeña de la estructura.
- La celda unitaria muestra el patrón que se encuentra en la estructura.
En una capa de átomos, la celda unitaria podría pensarse una vez más como un solo átomo. Sin embargo, podemos mostrar más claramente las relaciones entre estos átomos eligiendo una célula ligeramente diferente. La celda unitaria en una capa cuadrada simple es solo un cuadrado que contiene las esquinas de cuatro átomos vecinos. La celda unitaria en una capa hexagonal es un rombo que contiene las esquinas de cuatro átomos vecinos.
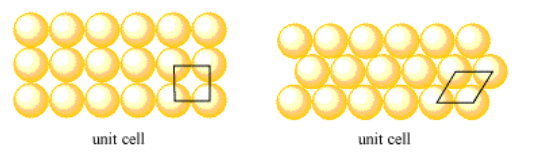
En los siguientes casos, mostrar que las celdas unitarias dadas se repiten en toda la estructura.
- capa cuadrada simple: una celda unitaria cuadrada
- capa hexagonal: una celda unitaria rómbica
Nota: en la capa hexagonal, puede encontrar una forma adicional de hacerlo si gira copias de la celda unitaria para obtener celdas unitarias orientadas en tres direcciones diferentes.
En los siguientes casos, mostrar qué fracciones de átomos se encuentran en la celda unitaria. Agrega las fracciones para encontrar el total combinado de átomos en la celda unitaria.
- capa cuadrada simple: una celda unitaria cuadrada
- capa hexagonal: una celda unitaria rómbica
Eficiencia de Empaque
La eficiencia del empaque es una de las preguntas que la gente se pregunta en las estructuras cristalinas. Se trata de cuán apretados están empaquetados los átomos en una estructura. A menudo, cuanto más apretada esté la estructura, mejor (pero no siempre sucede de esa manera).

¿Por qué podría favorecerse un empaque más apretado de átomos metálicos? Tiene que ver con el hecho de que los átomos metálicos están interactuando entre sí. Cuanto más cerca estén juntos, más fuertemente podrán interactuar.
Hay un par de formas en las que podemos pensar sobre esa interacción. En la idea más simple del modelo electrón-mar, los átomos metálicos se han convertido en cationes metálicos, y están rodeados de electrones. Cuanto más se acerquen los átomos metálicos a los electrones, más fuertemente interactuarán. En general, pensamos que los átomos metálicos comparten sus electrones; cuanto más cerca están los átomos metálicos entre sí, más eficientemente se pueden compartir los electrones.
Sólo trabajemos con esa idea de atracción electrostática. Imagina un grupo de átomos en una simple capa cuadrada. Todos los átomos están tocando a sus vecinos a ambos lados. Pensemos en la distancia entre un núcleo y un electrón individual en el mar de electrones. Sabemos que el núcleo está en el centro del átomo. No sabemos exactamente dónde está un electrón libre, pero supongamos que está en el centro del agujero más cercano. Recuerda, cuanto más cerca está el electrón del núcleo, menor es la energía.

A modo de comparación, tal vez haya otro conjunto de átomos, también en una simple capa cuadrada. Supongamos que están bien separados entre sí; tal vez estén lo suficientemente separados como para que puedas encajar un átomo extra entre cada par si quisieras. Si el electrón libre está en el mismo lugar —la mitad del agujero más cercano— se puede ver que está mucho más lejos del núcleo en este caso. La fuerza de atracción es mucho menor en este caso, y la energía general no es tan baja.
- La mayoría de los metales se empaquetan de manera muy eficiente para formar un sólido.
- El empaque eficiente conduce a interacciones de unión más fuertes.
Ese primer caso, con átomos empaquetados más apretadamente juntos, puede ser preferible, debido a la interacción más fuerte entre el núcleo metálico y el electrón libre. Por razones como esta, comprender la eficiencia del empaque en un cristal puede ser muy importante.
Ve a tu alcancía y saca un montón de centavos, monedas de cinco centavos, cuartos o diez centavos. Necesitarás al menos cuatro de cada uno, pero nueve de ellos es un buen número. Empaque un tipo de moneda en las siguientes capas:
- cuadrado simple
- hexagonal o cerrado
- Respuesta a:
-
Usando cuartos, la distancia es de aproximadamente 5 mm.
- Respuesta b:
-
Usando cuartos, la distancia es de aproximadamente 2.5 mm.
Un electrón libre estaría más cerca de los átomos en una capa hexagonal de empaquetamiento cerrado. Habría una atracción electrón-ion más fuerte en ese caso.
En cada caso, mida la distancia desde el borde de una moneda hasta el centro del agujero.
¿En qué caso el electrón libre está más cerca del átomo? ¿El sistema de empaque (el tipo de capa) tiene un efecto sobre cuán unidos están esos átomos?
Ve a tu alcancía y saca un montón de cuartos Y un montón de monedas de diez centavos. Necesitarás al menos cuatro de cada uno, pero nueve de ellos es un buen número. Empaque cada tipo de moneda en las siguientes capas:
- cuadrado simple
- hexagonal o cerrado
- Respuesta a:
-
Usando dimes, la distancia es de aproximadamente 3.5 mm.
- Respuesta b:
-
Usando dimes, la distancia es de aproximadamente 1.5 mm.
Un electrón libre estaría más cerca de los átomos si los átomos fueran más pequeños. Habría una atracción electrón-ion más fuerte en ese caso.
En cada caso, mida la distancia desde el borde de una moneda hasta el centro del agujero.
¿En qué caso el electrón libre está más cerca del átomo? ¿El tamaño del átomo tiene un efecto sobre cuán unidos están esos átomos?
Cuando un metal se funde, los átomos van de un conjunto regular de átomos fuertemente unidos a un conjunto de átomos móviles libremente unidos.
Compara los puntos de fusión de los siguientes metales, dados en grados Celsius.
potasio: 64 cesio: 29 litio 181 sodio: 98 francio: 27
- ¿Se puede determinar alguna tendencia entre estos valores?
- ¿Puede dar una explicación física para su observación? (Puede que hayas encontrado una tendencia, pero ¿puedes explicarla?)
- Respuesta a:
-
puntos de fusión (y fuerza de atracción entre átomos): Fr < Cs < K < Na < Li
- Respuesta b:
-
Esta tendencia refleja los tamaños de los átomos. El litio es el más pequeño y el francio el más grande. La atracción electrón/ iónica es mayor en Li y más débil en el Fr.
La eficiencia del empaque a menudo se determina de manera más rigurosa en términos del porcentaje de una celda unitaria que en realidad está ocupada por átomos. ¿Cuál es el área total de una celda unitaria en las siguientes capas?
- capa cuadrada simple.
- capa hexagonal.
- Respuesta a:
-
El área total de esta plaza es
\[Area = w^{2} \nonumber\]
en el que w = ancho de la celda unitaria. El ancho de la celda unitaria es
\[w = 2r \nonumber\]
en el que r = radio del átomo de titanio.
\[Area = 4r^{2} = 4 (2.00 \times 10^{-10} m)^{2} = 4(4.00 \times 10^{-20} m^{2}) = 1.60 \times 10^{-19} m^{2} \nonumber\]
- Respuesta b:
-
El área total de este rombo es
\[Area = s^{2} sin \theta \nonumber\]
en el que s = un lado de la celda unitaria y θ = un ángulo de la celda unitaria (ya sea 60° o 120°). Pero
\[s = 2r \nonumber\]
en el que r = radio del átomo de titanio.
\[Area = (2 \times 2.00 \times 10^{-10} m)^{2} sin (60) = 1.60 \times 10^{-19} (0.87) m^{2} = 1.39 \times 10^{-19} m^{2} \nonumber\]
Se puede suponer que los átomos son de titanio. El titanio tiene un radio atómico de 2.00 Angstroms (o 2.00 x 10 -10 m).
¿Cuántos átomos de titanio hay en una celda unitaria en las siguientes capas?
- capa cuadrada simple.
- capa hexagonal.
- Respuesta a:
-
\[4 \times \frac{1}{4} = 1 \: atom \nonumber\]
- Respuesta b:
-
\[2 \times \frac{1}{6} + 2 \times \frac{1}{3} = \frac{2}{6} + \frac{4}{6} = 1 \: atom \nonumber\]
Es posible que necesites sumar fracciones de átomos de titanio para llegar a la respuesta. La respuesta puede ser o no un número entero.
¿Cuál es el área ocupada por un átomo de titanio?
(Si crees que la pregunta es ambigua, supongamos que nos preocupa el área de una sección transversal del átomo en su parte más ancha. Se trata de un átomo esférico, pero estamos tratando con su proyección en dos dimensiones, es decir, su sombra cuando el sol está directamente sobre la cabeza).
- Contestar
-
El área transversal (bidimensional) de un átomo de titanio es el área de un círculo
\[Area = \pi r^{2} \nonumber\]
\[Area = 3.1415 \times (2.00 \times 10^{-10} m)^{2} = 3.1415 \times 4.00 \times 10^{-20} m^{2} = 1.257 \times 10^{-19} m^{2} = 1.26 \times 10^{-19} m^{2} \nonumber\]
En los siguientes casos, ¿qué porcentaje de la celda unitaria está llena de átomos de titanio?
- capa cuadrada simple.
- capa hexagonal.
- Respuesta a:
-
\[Efficiency = \frac{occupied}{total} \times 100 \% = \frac{1.26 \times 10^{-19} m^{2}}{1.39 \times 10^{-19} m^{2}} \times 100 \% = 91 \% \nonumber\]
- Respuesta b:
-
\[Efficiency = \frac{occupied}{total} \times 100 \% = \frac{1.26 \times 10^{-19} m^{2}}{1.39 \times 10^{-19} m^{2}} \times 100 \% = 91 \% \nonumber\]
Un mayor porcentaje de espacio se ocupa en empaque hexagonal cerrado.
El porcentaje de celda unitaria que está ocupada por átomos se denomina “la eficiencia de empaquetamiento”.
Número de Coordinación
Hay una serie de términos utilizados para describir las relaciones entre los átomos y los átomos a los que están directamente unidos. Por ejemplo, usamos el término “número de coordinación” para describir el número de otros átomos que un átomo específico está tocando en una capa regular.
¿Cuál es el número de coordinación de un átomo en
- capa cuadrada simple
- capa hexagonal
- Respuesta a:
-
número de coordinación = 4
- Respuesta b:
-
número de coordinación = 6
Cuál es el número de coordinación de un átomo en las siguientes capas:

- Respuesta a:
- Respuesta b:
Respuesta A:Suponiendo que el patrón se extiende linealmente, número de coordinación = 2. De lo contrario, número de coordinación = 2 para átomos interiores y número de coordinación = 1 para átomos terminales.Respuesta B:Suponiendo que el patrón se extiende en dos dimensiones, número de coordinación = 3. De lo contrario, número de coordinación = 3 para átomos interiores, número de coordinación = 2 para átomos de borde lateral y número de coordinación = 1 para átomos de esquina.Imágenes para el Ejercicio 2.2.14 a y b. a es una sola fila de seis átomos. b es una disposición hexagonal de átomos; cada hexágono tiene un centro vacío y está compuesto por seis átomos.
Geometría de Coordinación
Echa un vistazo a todos los átomos que rodean un átomo específico en una capa. Si tuvieras que trazar una línea desde el centro de uno de estos átomos al siguiente, e ir todo el camino hasta volver al principio, obtendrías una forma específica. Esa forma se describe como la geometría de coordinación del átomo central. Está estrechamente relacionado con el número de coordinación. En dos dimensiones, dos átomos con el mismo número de coordinación siempre tienen la misma geometría de coordinación. Ocasionalmente en tres dimensiones, dos átomos con el mismo número de coordinación pueden tener diferentes geometrías de coordinación; los átomos que están tocando pueden estar dispuestos de formas ligeramente diferentes.
¿Cuál es la geometría de coordinación de un átomo en
- capa cuadrada simple
- capa hexagonal
Cuál es la geometría de coordinación de un átomo en las siguientes capas:

Celosía
A veces, la disposición de los átomos en un cristal se conoce como “una matriz” o “una red”. En este punto, una matriz o celosía es solo la red bidimensional de átomos en una capa. Posteriormente, veremos matrices tridimensionales de átomos. Los sólidos metálicos suelen ser tridimensionales, no bidimensionales. No obstante, a medida que empezamos a construir hasta una tercera dimensión, verás que la mayoría de las ideas de esta página tienen analogías en 3D.

