2.3: Construcción de átomos metálicos en tres dimensiones
- Page ID
- 80698
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
¿Qué tipo de estructuras componen el mundo que nos rodea? ¿Qué tipo de formas vemos en los bloques de construcción del mundo material? Los antiguos griegos daban especial importancia a ciertas formas perfectas, o sólidos platónicos. Estas formas se consideraron perfectas porque eran tan regulares, con lados de igual tamaño dispuestos en ángulos idénticos entre sí, de modo que el sólido se vería igual cuando se veía desde diferentes ángulos. Por ejemplo, un cubo tiene cuatro lados cuadrados, todos conectados en ángulo recto entre sí. Estos sólidos platónicos se asociaron a veces con los elementos clásicos percibidos en su momento: tierra, aire, fuego y agua.

Como sucede, los griegos no estaban tan lejos de la verdad. Ciertos sólidos aparecen frecuentemente en las estructuras de la naturaleza, incluyendo los sólidos platónicos clásicos. Estas formas simplemente describen la forma natural en que un grupo de átomos podría organizarse cuando se unen para construir una estructura más grande. Muy a menudo, encontramos un átomo en el centro de un sólido platónico, con otros átomos dispuestos a su alrededor para formar las esquinas del sólido.
Además del cubo mostrado anteriormente, el tetraedro y el octaedro son sólidos platónicos extremadamente comunes que se encuentran en estructuras naturales. Un par de sólidos no platónicos que a veces vemos son la pirámide cuadrada (piense en los de Egipto) y la bipirámide trigonal; sin embargo, no encontraremos a los de la naturaleza por algunos capítulos más.

Para cada uno de los siguientes sólidos, identifique el número de (i) esquinas y (ii) caras.
a) cubo b) tetraedro c) pirámide cuadrada d) bipirámide trigonal e) octaedro
- Respuesta a:
-
i) 8
ii) 6
- Respuesta b:
-
i) 4
ii) 4
- Respuesta c:
-
i) 5
ii) 5
- Respuesta d:
-
i) 5
ii) 6
- Respuesta e:
-
i) 6
ii) 8
Veremos formas cúbicas, octaédricas y tetraédricas surgiendo a medida que observamos las estructuras de sólidos extendidos como metales y sales. En estado sólido, los metales son estructuras muy limpias y ordenadas. Los átomos metálicos forman una estructura cristalina tridimensional. Empezaremos a pensar en esas estructuras viendo cómo se pueden construir a partir de capas más simples y bidimensionales.
Construyendo desde Cuadrados: Empaque Cúbico Simple
Toma una simple capa cuadrada de átomos. Supongamos que se forma otra capa encima de esa, con átomos dispuestos de la misma manera que la primera capa. Cada átomo en la segunda capa se asienta directamente encima de un átomo en la primera capa.
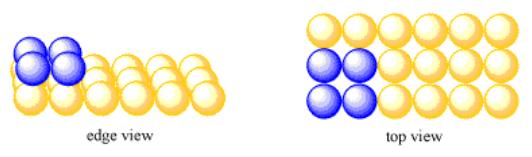
Esta es una estructura muy ordenada, ordenada y simple. Todos los átomos están alineados en filas rectas, pasillos y columnas. La estructura se ve exactamente igual si se ve a lo largo del eje x, a lo largo del eje y o a lo largo del eje z.
La unidad repetitiva más simple en tres dimensiones suele considerarse como una caja o cubo con átomos en cada una de sus ocho esquinas. Alternativamente, podríamos pensar en la unidad repetitiva como un cubo con un átomo en su centro. Sin embargo, es útil ver las relaciones entre múltiples átomos en la celda unitaria. Por esa razón, solemos imaginar la celda unitaria como el cubo con un átomo en cada esquina. Debido a que cada una de esas esquinas se comparte entre varias celdas unitarias, es mejor pensar en cada celda unitaria como que solo posee una fracción de cada átomo de esquina.
- Una celda unitaria cúbica simple se basa en una capa cuadrada.
- Los cuadrados de los átomos se repiten en las direcciones x, y y z.

En las siguientes secciones, las celdas unitarias se mostrarán con átomos separados aún más entre sí porque las relaciones entre los átomos son aún más complejas. En el caso de un sistema de empaque cúbico simple, la celda unitaria se mostraría de la siguiente manera:

Eche un vistazo a la celda unitaria cúbica simple.
- ¿Qué fracción de átomo se encuentra en cada esquina de la celda unitaria cúbica simple?
- ¿Cuántas esquinas hay en el cubo?
- ¿Cuál es el número total de átomos en la celda unitaria cúbica simple?
- Respuesta a:
-
1/8 átomo en cada esquina
- Respuesta b:
-
8 esquinas en un cubo
- Respuesta c:
-
\(8 \times \frac{1}{8} = 1\)átomo por cubo simple
Construcción a partir de cuadrados: Empaque cúbico centrado en el cuerpo
Esa no es la única manera de construir un sólido tridimensional a partir de una simple capa cuadrada. Recuerda de la discusión de las capas que los átomos pueden sentarse un poco más apretados juntos al tambalearse, para que un átomo no se asiente directamente detrás de otro. En cambio, un átomo en la segunda fila se sienta detrás de un par de átomos en la primera fila, y justo entre ellos visto desde el frente. Este tipo de escalonamiento también ocurre fácilmente en tres dimensiones.
De hecho, si tomas cuatro naranjas y haces un cuadrado con ellas, y luego decides colocar una quinta naranja encima de esa capa, ¿dónde está el lugar obvio para poner esta última naranja? Lo pondrías justo en medio de los cuatro primeros, encaramado en el pequeño valle encima de ellos.

Si tienes una caja entera llena de naranjas, puedes hacer una primera capa más grande de naranjas, y comenzar a colocar naranjas adicionales en todos los pequeños valles cuadrados entre las naranjas de la primera capa. Pronto encontrarás que has construido una segunda capa cuadrada simple. Es igual que la primera capa, pero compensada por media celda unitaria hacia un lado y media celda unitaria hacia atrás.
Puedes seguir agregando más capas hasta que te quedes sin naranjas o todo se caiga y se salga rodando. Si lo haces, podrías notar que todas las naranjas de la tercera capa se asientan directamente encima de las naranjas en la primera capa, y todas las naranjas de la cuarta capa se sientan directamente encima de las de la segunda capa. Eso se debe a que cada nueva capa está desplazada por media celda unitaria, por lo que cada dos capas, ese desplazamiento se suma a una celda unitaria, y las naranjas se alinean de nuevo. Este patrón a veces se describe como un patrón ABABAB; eso significa que las capas impares se alinean exactamente entre sí, y las capas pares se alinean exactamente entre sí.
- El empaquetamiento cúbico centrado en el cuerpo permite que la segunda capa de átomos se acerque un poco más a los átomos de la primera capa.
La celda unitaria en este sistema, al igual que el sistema cúbico simple, es un cubo con un octavo de átomo (o naranja) en cada esquina. Sin embargo, los átomos de esquina no se encuentran en capas adyacentes, sino en capas alternas (como la primera y la tercera). Un átomo de la capa media también se incluye en la célula; el átomo completo está justo en el centro de la celda unitaria. Este sistema de empaque se llama cúbico centrado en el cuerpo.
- La celda unitaria de un sistema cúbico centrado en el cuerpo se parece mucho a la celda unitaria cúbica simple.
- La celda unitaria cúbica centrada en el cuerpo tiene un átomo extra en su centro.

Una nota importante: en un sistema cúbico centrado en el cuerpo (y los otros sistemas a seguir), los átomos en la primera capa no se tocan del todo entre sí. Al retroceder ligeramente el uno del otro dentro de una capa, hay interacciones más cercanas de una capa a otra. El espacio adicional permitido al extender un poco una capa individual permite que las capas posteriores de átomos se aniden más profundamente en esos valles. Las interacciones de unión más fuertes resultan de esas conexiones cercanas entre las capas.
Por cierto, te costaría construir una estructura cúbica simple con naranjas, a menos que las pegaras juntas o usaras naranjas ligeramente aplanadas, como clementinas. Hay más soporte estructural en la estructura cúbica centrada en el cuerpo, porque las naranjas que descansan en los valles están distribuyendo su peso y recibiendo apoyo de cuatro naranjas debajo de ellas, no solo una.
Eche un vistazo a la celda de la unidad cúbica centrada en el cuerpo.
- ¿Qué fracción de átomo se encuentra en cada esquina de la celda unitaria cúbica centrada en el cuerpo?
- ¿Cuántas esquinas hay en el cubo?
- ¿Hay átomos en algún otro lugar del cubo?
- ¿Cuál es el número total de átomos en la celda unitaria cúbica centrada en el cuerpo?
- Respuesta a:
-
1/8 átomo en cada esquina
- Respuesta b:
-
8 esquinas en un cubo
- Respuesta c:
-
1 átomo en medio del cubo
- Respuesta d:
-
\(1 + 8 \times \frac{1}{8} = 2\)átomos por cubo centrado en el cuerpo
Construcción a partir de Capas Hexagonales: Empaque Hexagonal
Algunos átomos metálicos forman capas hexagonales. En lugar de estar en estrecho contacto con cuatro átomos vecinos en una capa, un átomo en una capa hexagonal está en estrecho contacto con seis átomos vecinos.
¿Aún tienes tus naranjas? Supongamos que comienzas con una capa hexagonal de ellos. Cuando se agrega otra capa de naranjas encima de una capa hexagonal, las naranjas nuevas no se asientan justo encima de las de la primera capa. En cambio, se sientan en los pequeños valles entre las naranjas de la primera capa. Esto es un poco como la segunda capa de empaque cúbico centrado en el cuerpo. La diferencia es que, en el empaque cúbico centrado en el cuerpo, todos los valles entre las naranjas de la primera capa están ocupados por naranjas de la segunda capa. En empaque hexagonal, cada naranja en la primera capa tiene seis pequeños valles a su alrededor. No puedes meter fácilmente seis naranjas en todos esos valles al mismo tiempo; no hay suficiente espacio. En cambio, solo cada otro valle está ocupado por una naranja, formando la segunda capa.

En el dibujo, podrías notar que los átomos en una capa están ligeramente separados entre sí. Eso es también a la segunda capa de átomos para encajar más profundamente en los valles entre los átomos en la primera capa. Se abandona alguna interacción cercana entre los átomos dentro de una capa para obtener mejores interacciones entre los átomos en diferentes capas. Es una compensación que conduce a interacciones un poco más fuertes en general.
Nuevamente, al igual que los sistemas basados en cuadrados simples, la segunda capa que forma se parece mucho a la primera. Es otra capa hexagonal. Se desplaza alejándose de la primera capa por medio átomo hacia un lado, y medio átomo hacia la parte delantera o trasera.
- Las capas hexagonales no suelen estar apiladas con átomos directamente una encima de la otra.
- Las capas hexagonales se acercan un poco más entre sí al desplazarse para que los átomos de arriba puedan sentarse en los valles de abajo.
- No hay lugar para que cada valle sea ocupado por un átomo. Todos los demás valles se dejan abiertos.
Una vez que comencemos a agregar una tercera capa, tenemos la opción. Al igual que con la segunda capa, no podemos agregar una naranja nueva a cada valle. Tendremos que agregarlos a todos los demás valles. Podemos agregarlas directamente sobre las naranjas en la primera capa, o directamente sobre los valles que quedaron vacíos cuando rellenamos la segunda capa.

Pongámoslas directamente sobre las naranjas en la primera capa. Cuando añadimos las naranjas para la cuarta capa, las pondremos directamente sobre las de la segunda capa. Este sistema de empaque se llama empaque cerrado hexagonal.
- En empaque hexagonal cerrado, la tercera capa de átomos está directamente por encima de la primera capa.
- Este sistema es un poco como cúbico ceneado por cuerpos, pero con una base hexagonal en lugar de una cuadrada.
Antes de considerar la celda unitaria en este sistema (que es un poco más complicado que en los sistemas de empaque cúbico), echemos un vistazo a estas capas de átomos, con una separación un poco mayor.
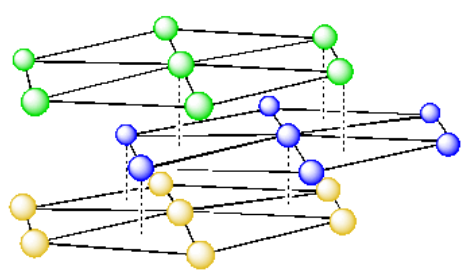
Debido a que los átomos en la capa superior están directamente sobre los átomos en la capa inferior, podemos pensar que estas dos capas son idénticas. Podemos demostrarlo dibujándolos en el mismo color.

En una sola capa hexagonal, la celda unitaria era un rombo. Podríamos usar eso para construir la celda de la unidad para un sistema hexagonal cerrado. Simplemente agregaríamos paredes a la celda para construir la unidad repetitiva más simple.

El patrón de capas en el sistema de empaquetamiento cúbico simple fue AAAAAA; cada capa se colocó de manera que cada átomo estaba directamente por encima de un átomo en la capa debajo de él. El patrón de capas en el arreglo cúbico centrado en el cuerpo fue ABABAB; cada átomo en una capa estaba directamente por encima de uno que estaba dos capas hacia abajo. ¿Qué patrón se ajusta al empaque hexagonal?
- Contestar
-
El patrón de cierre hexagonal es ABAB.
Eche un vistazo a la celda unitaria hexagonal empaquetada.
- ¿Qué fracción de átomo se encuentra en cada esquina de la celda unitaria cúbica hexagonal cerrada?
- Sumando todas esas fracciones, ¿cuántos átomos de esquina hay dentro de la celda?
- ¿Hay átomos en algún otro lugar de la celda?
- ¿Cuál es el número total de átomos en la celda unitaria hexagonal cerrada?
- Respuesta a:
-
Tanto en la capa superior como en la inferior, dos átomos están 1/3 dentro de la celda y dos átomos están 1/6 dentro de la celda.
- Respuesta b:
-
Eso hace que el\(2 \times (2 \times \frac{1}{3} + 2 \times \frac{1}{6}) = \frac{4}{3} + \frac{4}{6} = \frac{4}{3} + \frac{2}{3} = 1\) átomo sea total en las esquinas
- Respuesta c:
-
1 átomo dentro de la célula.
- Respuesta d:
-
2 átomos en total.
En la siguiente variación del empaque hexagonal cerrado, las dos celdas unitarias parecen ser ligeramente diferentes.

- ¿Cuál es la relación entre las dos celdas unitarias en la estructura anterior?
- ¿Cómo describiría las relaciones entre las capas en la estructura anterior (es decir, ABCABC etc)?
- Contestar
-
El patrón en esta variación es ABACA.
Construcción a partir de Capas Hexagonales: Empaque Cubico Cerrar (o Empaque Centrada en Cara
Comienza con la misma capa hexagonal de naranjas. Una vez más, cuando se agrega otra capa encima de esa capa hexagonal, las naranjas nuevas no se asientan justo encima de las de la primera capa. En cambio, se sientan en los pequeños valles entre las naranjas de la primera capa. Recuerda, en empaque hexagonal, cada naranja en la primera capa tiene seis pequeños valles a su alrededor. No puedes meter fácilmente seis naranjas en todos esos valles al mismo tiempo; no hay suficiente espacio. En cambio, solo cada otro valle está ocupado por una naranja, formando la segunda capa.
Nuevamente, al igual que en los otros sistemas, la segunda capa se parece mucho a la primera. Es otra capa hexagonal. Se desplaza alejándose de la primera capa.

Una vez que comencemos a agregar una tercera capa, tenemos la opción. Al igual que con la segunda capa, no podemos agregar una naranja nueva a cada valle. Tendremos que agregarlos a todos los demás valles. Podemos agregarlas directamente sobre las naranjas en la primera capa, o directamente sobre los valles que quedaron vacíos cuando rellenamos la segunda capa.

Esta vez, pongámoslos directamente sobre los agujeros de la primera capa que antes no estaban llenos. Cuando añadimos las naranjas para la cuarta capa, las pondremos directamente sobre las naranjas en la primera capa. Las naranjas en la quinta capa se sentarán por encima de las de la segunda capa, y las de la sexta capa se sentarán sobre las de la tercera capa.
- En el empaque cerrado cúbico, las capas son en realidad hexagonales (también llamadas “empaquetadas”).
- En la tercera capa, los átomos no se encuentran directamente por encima de los átomos en la primera capa.
- En cambio, los átomos en la tercera capa se asientan por encima de los valles vacíos desde la primera capa.
Este sistema de empaque se llama empaque cúbico cerrado o empaque cúbico centrado en la cara.

El patrón de capas en el sistema de empaque cúbico simple fue AAAAAA. El patrón de capas en el arreglo cúbico centrado en el cuerpo fue ABABAB. ¿Cómo describirías el patrón en empaque cerrado cúbico?
- Contestar
-
ABCABC.
La celda unitaria en el sistema hexagonal de empaquetamiento cerrado se basó en una celda unitaria de una sola capa. Proponer una celda unitaria similar para un sistema cúbico cerrado.
- ¿Qué celda unitaria bidimensional forma la base de esta celda unitaria tridimensional?
- ¿Cuántas capas corta la celda unitaria cúbica empaquetada?
- Dibuje la celda unitaria cúbica empaquetada.
- Respuesta a:
-
La celda unitaria hexagonal en forma de rombo.
- Respuesta b:
-
4 capas.
Oye, espera un minuto. ¿Por qué lo llaman empaque cúbico si la celda unitaria se basa en un rombo en lugar de un cuadrado? A lo mejor hay otra manera de ver esta estructura. A lo mejor hay una celda unitaria alternativa.

Hay una celda unitaria cúbica, pero es más difícil de ver. El cubo se inclina en una de sus esquinas. Desmontaremos algunos de los átomos adicionales en las capas hexagonales para que podamos tener una mejor apariencia.

Hay un átomo en la capa más baja que forma una esquina del cubo. La esquina opuesta del cubo es un átomo en la cuarta capa. Ese átomos se asienta directamente encima del que está en la primera capa, la esquina inferior del cubo. En el medio, tres caras del cubo están inclinadas hacia abajo. Hay un átomo en el medio de cada una de estas caras; junto con los átomos en las tres esquinas entre ellas, estos forman una segunda capa en la estructura. También hay tres caras inclinadas hacia arriba. Hay un átomo en el centro de cada una de estas caras; junto con los átomos en las tres esquinas entre ellas, estos forman una tercera capa en la estructura.

Tenga en cuenta que este cubo tiene un átomo en el centro de cada cara; de ahí el nombre, cúbico centrado en la cara.
- Un cúbico cerrado toma el nombre “cúbico” de la presencia de una celda unitaria cúbica.
- Esta celda unitaria cúbica está orientada diagonalmente a las capas empaquetadas.
- Esta celda unitaria cúbica tiene un átomo en el cenetro de cada cara; también se le llama “cúbico centrado en la cara”.
Eche un vistazo a su nueva celda unitaria cúbica empaquetada.
- ¿Qué fracción de átomo se encuentra en cada esquina de la celda unitaria cúbica cerrada?
- ¿Cuántas esquinas hay en la celda?
- ¿Hay átomos en algún otro lugar de la celda?
- ¿Cuál es el número total de átomos en la celda unitaria cúbica cerrada?
- Respuesta a:
-
1/8 átomo en cada esquina
- Respuesta b:
-
8 esquinas en un cubo
- Respuesta c:
-
1/2 átomo en cada cara del cubo
- Respuesta d:
-
\(6 \times \frac{1}{2} + 8 \times {1}{8} = 4\)átomos por cubo centrado en la cara
El tipo de empaque adoptado por un metal en realidad tiene alguna influencia en las propiedades físicas del metal. Por ejemplo, los metales que están estrechamente asociados con el trabajo del metal durante la antigüedad, como el plomo, el oro, la plata y el cobre, generalmente adoptan estructuras cúbicas muy empaquetadas. Estos metales tienen altos valores de “ductilidad física”, un índice de la facilidad con la que se pueden estirar en alambre. El titanio, el cobalto y el zinc están empaquetados hexagonales y tienen valores moderados de ductilidad física. Los metales que adoptan empaque cúbico centrado en el cuerpo, como hierro, tungsteno y cromo, generalmente tienen menor ductilidad física.
Esta tendencia no es una regla estricta; algunos metales centrados en el cuerpo son más dúctiles que algunos metales cúbicos apretados. Sin embargo, el empaque de metal parece ser un factor en la facilidad con la que los metales se pueden estirar, doblar y trabajar. La razón por la que juega un papel es por la presencia de “planos de deslizamiento” en la estructura metálica. ¿Recuerdas la idea de que filas de átomos metálicos pueden deslizarse entre sí? Resulta que los metales cúbicos muy empaquetados forman filas en muchas direcciones diferentes, por lo que sus átomos pueden deslizarse entre sí con bastante facilidad. En contraste, ese átomo central en una célula cúbica centrada en el cuerpo actúa como un bache de velocidad para la capa de átomos por encima y por debajo de ella, ralentizando su movimiento.
Anteriormente vimos que el número de vecinos cercanos de un átomo metálico se llama el número de coordinación. ¿Cuál es el número de coordinación en cada uno de los siguientes casos?
- un átomo en la esquina de una simple celda cúbica. Recuerden, también está rodeado de otras celdas unitarias.
- un átomo en el centro de una célula cúbica centrada en el cuerpo.
- un átomo en la esquina de una celda cúbica centrada en el cuerpo.
- un átomo en la esquina de una celda cúbica centrada en la cara.
- un átomo en la cara de una celda cúbica centrada en la cara.
- Respuesta a:
-
número de coordinación = 6 (3 dentro del cubo, a lo largo de los tres bordes adyacentes, más tres en cubos adyacentes).
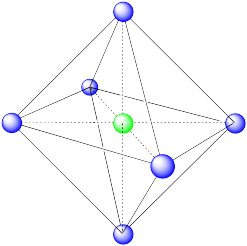
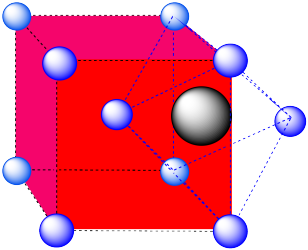
En la imagen, consideremos el átomo verde coordinado por sus vecinos más cercanos, los átomos azules. Una celda unitaria se resalta en rojo.

Aquí está el ambiente de coordinación sin los átomos circundantes.

Se muestra una sola celda unitaria para comparación. Los otros tres átomos más cercanos están en celdas abajo, detrás y a la derecha del que se muestra.

- Respuesta b:
-
número de coordinación = 8 (esquinas del cubo).

Aquí está el ambiente de coordinación sin los átomos circundantes.
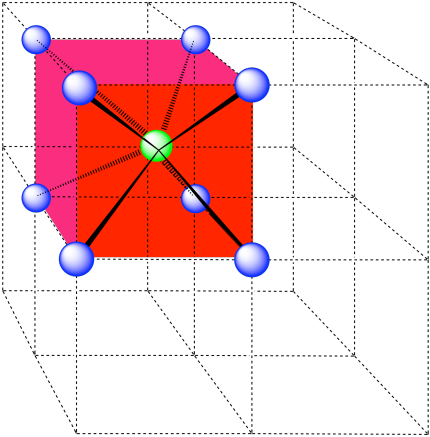
A continuación se muestra una sola celda unitaria para mayor simplicidad. Todos los átomos coordinados se encuentran dentro de la célula.

- Respuesta c:
-
Los átomos más cercanos están en los centros de las celdas adyacentes; las otras esquinas están más alejadas; número de coordinación = 8.

Aquí está el ambiente de coordinación sin los átomos circundantes.

A continuación se muestra una sola celda unitaria, para mayor simplicidad. Debido a que el átomo está en una esquina, hay otras ocho celdas dispuestas alrededor de esta: una a la derecha, dos detrás, y luego cuatro más abajo.

- Respuesta d:
-
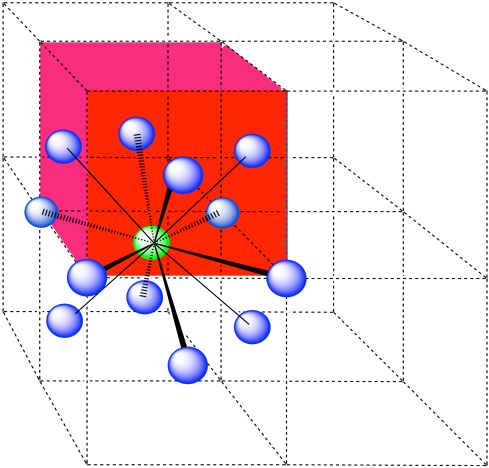
Los átomos más cercanos están en las caras adyacentes a la posición de esquina; estas caras se encuentran a lo largo de tres planos, con cuatro caras rodeando la esquina en cada plano; umber de coordinación = 12.
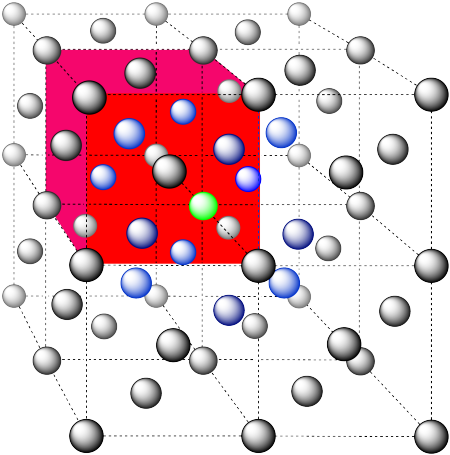
Aquí está el ambiente de coordinación, sin los átomos que están más lejos del verde.

A continuación se muestra una sola celda unitaria. Debido a que el átomo está en una esquina, hay otras siete celdas dispuestas alrededor de esta: una a la derecha, dos detrás, y luego cuatro más abajo.

- Respuesta e:
-
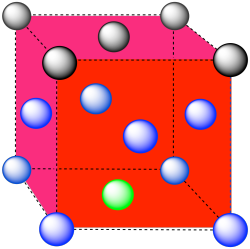
Los átomos más cercanos están en las esquinas alrededor de la cara (4), así como los átomos en el medio de cada cara adyacente (8); número de coordinación = 12.

Aquí está el ambiente de coordinación sin los otros átomos.
A continuación se muestra una sola celda unitaria. Hay otra celda directamente debajo de ella.
La geometría de coordinación está relacionada con el número de coordinación. ¿Cuál es la geometría de coordinación en cada uno de los siguientes casos?
- un átomo en la esquina de una simple celda cúbica. Recuerden, también está rodeado de otras celdas unitarias.
- un átomo en el centro de una célula cúbica centrada en el cuerpo.
- un átomo en la esquina de una celda cúbica centrada en el cuerpo.
Aprendimos antes sobre los agujeros o espacios intersticiales entre los átomos en una capa. También hay agujeros entre los átomos en una estructura tridimensional. Por ejemplo, cómo describirías la forma de los agujeros en los siguientes casos:
- el agujero en medio de una celda cúbica simple.
- un agujero entre el átomo central y la cara de una celda cúbica centrada en el cuerpo.
- el agujero justo en el medio de la cara de una celda cúbica centrada en el cuerpo.
- el agujero entre los átomos formando un valle en una capa hexagonal y el átomo sentado en el valle.
- el agujero entre los átomos formando un valle vacío en una capa hexagonal y los átomos en la capa anterior.
- Respuesta a:
-
Un agujero cúbico.
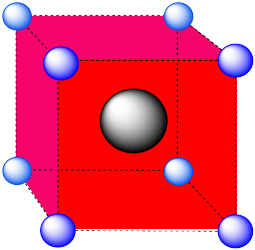
- Respuesta b:
-
Un agujero piramidal cuadrado. El átomo en el agujero está por encima de un cuadrado de átomos, con un átomo adicional justo encima de él.

- Respuesta c:
-
Un agujero octaédrico. El átomo que ocupa el agujero ha sido empujado hasta la cara del cubo. Está justo en medio de un cuadrado de átomos. Uno de los vértices está en el centro del siguiente cubo.
- Respuesta d:
-
Un agujero tetraédrico. Tenga en cuenta que las capas en el sistema cúbico más cercano discurren diagonalmente a través de la celda unitaria cúbica. El átomo en el agujero se asienta sobre un trío de átomos en tres caras adyacentes, y es rematado por el átomo en la esquina del cubo. Debido a que un tetraedro es tan simétrico, la disposición se puede describir de varias otras maneras, eligiendo tres átomos circundantes como base y el cuarto átomo como la tapa del tetraedro.

- Respuesta e:
-
Un octaedro. Nuevamente, las capas hexagonales discurren diagonalmente a través de la celda unitaria.

La eficiencia del empaque a menudo se determina en términos del porcentaje del volumen de una celda unitaria que realmente está ocupada por átomos.
En los siguientes casos, calcule el volumen de toda la celda unitaria.
- una celda unitaria cúbica simple.
- una celda unitaria cúbica centrada en el cuerpo.
- una celda de unidad cúbica centrada en la cara.
- una celda unitaria hexagonal muy empaquetada (recuerde, esta celda es un prisma rómbico, no un cubo).
Se puede suponer que los átomos en la celda son de titanio. El titanio tiene un radio atómico de 2.00 Angstroms (o 2.00 x 10 -10 m).
¿Cuántos átomos hay en una celda unitaria en las siguientes capas?
- una celda unitaria cúbica simple.
- una celda unitaria cúbica centrada en el cuerpo.
- una celda de unidad cúbica centrada en la cara.
- una celda unitaria hexagonal muy empaquetada (recuerde, esta celda es un prisma rómbico, no un cubo).
Es posible que tengas que sumar fracciones de átomos de titanio para llegar a la respuesta. La respuesta puede ser o no un número entero.
¿Cuál es el volumen que ocupa un átomo de titanio?
En los siguientes casos, ¿qué porcentaje de la celda unitaria estaría llena de átomos de titanio?
- una celda unitaria cúbica simple.
- una celda unitaria cúbica centrada en el cuerpo.
- una celda de unidad cúbica centrada en la cara.
- una celda unitaria hexagonal empaquetada.
El porcentaje de celda unitaria que está ocupada por átomos se denomina “la eficiencia de empaquetamiento”.
Utilice la plantilla apropiada para dibujar una celda unitaria para cada uno de los siguientes metales.

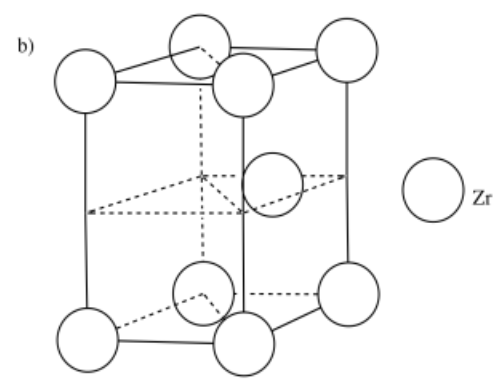
a) hierro, Fe, es BCC b) circonio, Zr, es HCP c) cobre, Cu, es FCC
d) manganeso, Mn, es BCC e) platino, Pt, es CCP f) osmio, Os, es HCP
- Respuesta a:
-

- Respuesta b:
-
- Respuesta c:
-

- Respuesta d:
-

- Respuesta e:
-

- Respuesta f:
-
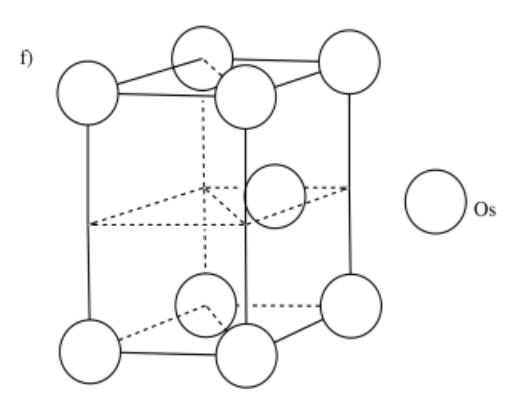
¿Quieres ver alguna información adicional? Prueba estos otros sitios que proporcionan imágenes tridimensionales de cómo los átomos se agrupan.
Laboratorio de empaque de cristal Kings College
Sitio de Laboratorio de Investigación Naval
Sitio de estado sólido en Liverpool
Visualización de estructuras de estado sólido: celdas unitarias, etc.
Estructuras Sólidas de Oxford University
Visualización de estructuras de estado sólido: celdas unitarias, etc.