4.6: La necesidad de estructuras de resonancia
- Page ID
- 80591
El anión carbonato que se muestra a continuación tiene un doble enlace y dos enlaces simples. Normalmente, el número de enlaces entre dos átomos en la estructura de Lewis puede indicarle qué tan cerca se mantienen los dos átomos. Eso significa que hay un enlace C-O en la molécula que es más corto que los otros dos.
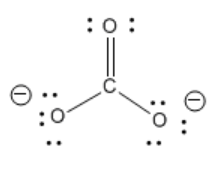
Sin embargo, el ion carbonato es una excepción a la regla. De hecho, el ion carbonato es una molécula plana simétrica, trigonal. Las tres distancias de enlace carbono-oxígeno son de aproximadamente 1.28 Angstroms de largo.
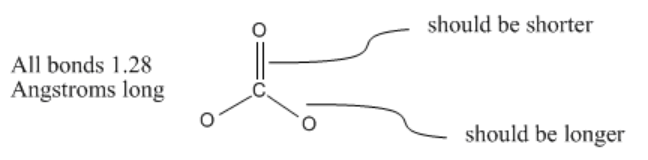
No se puede dibujar una estructura de Lewis que sugiera que los tres enlaces tienen la misma longitud. En cambio, puedes usar estructuras de resonancia para entender este hecho. Las estructuras de resonancia son solo estructuras alternas de Lewis que tienen en cuenta diferentes arreglos posibles de pares solitarios y múltiples enlaces para una estructura esquelética dada. En el carbonato, hay tres formas de organizar estos electrones adicionales.
Si etiquetas los átomos de oxígeno A, B y C, como se muestra a continuación, entonces A tiene un doble enlace en 1/3 de las estructuras que podrías dibujar, pero tendría un enlace sencillo en los otros 2/3 de las formas en que podrías dibujar la estructura. Lo mismo es cierto para los átomos B y C.
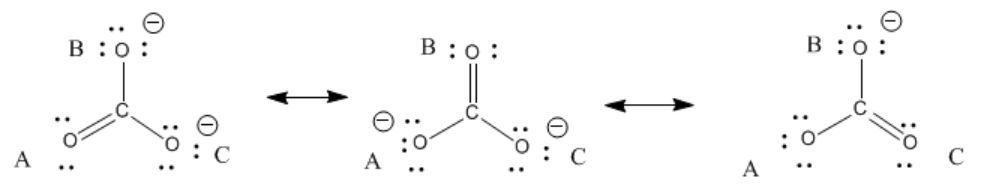
De hecho, el carbonato realmente tiene alrededor de 1-1/3 enlaces entre cada carbono y oxígeno. Además, no hay una carga negativa completa en ninguno de los oxígenos sino alrededor de dos tercios de una carga negativa en cada uno de los tres oxígenos.
Ocasionalmente podríamos dibujar una estructura que muestre enlaces parciales entre átomos como líneas discontinuas para sugerir, en este caso, 1-1/3 enlaces en lugar de uno o dos enlaces. También podríamos escribir (“delta menos”) para denotar una carga negativa parcial.
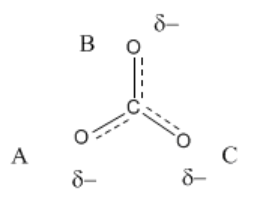
La limitación de este tipo de dibujo es que no logra mostrarnos exactamente cuántos electrones estamos tratando. Más adelante en el curso, será muy importante realizar un seguimiento de todos los electrones en las moléculas a medida que sufren reacciones químicas. En consecuencia, casi siempre dibujamos diferentes estructuras posibles de Lewis y tenemos en cuenta que la estructura es algo así como una combinación de todas ellas.
Cuando tenemos estructuras que difieren sólo en la forma en que están dispuestos sus electrones, pero que tienen exactamente la misma conectividad entre los átomos, nos referimos al conjunto de estructuras como estructuras de resonancia. Las flechas de doble punta entre las estructuras de resonancia es el símbolo que usamos para decir que tenemos dos o más formas diferentes de dibujar la misma estructura, y que necesitamos tener en cuenta todas las estructuras para entender cómo se comporta realmente la molécula.
Aquí hay una sutileza. El compuesto no es una estructura ni la otra, y no es un equilibrio donde la estructura cambia rápidamente de un lado a otro. Se trata de una superposición, en la que una sola molécula puede comportarse como las tres estructuras al mismo tiempo.
Dibujar conjuntos de estructuras de resonancia para los siguientes compuestos.
a) ion cianato, NCO - (una estructura lineal) e) ion azida, NNN -
b) ion formiato, HCO 2 - f) diazometano, CH 2 NN
c) ozono, O 3 (una estructura doblada o “boomerang”) g) ion enolato, CH 2 CHO -
d) ión nitrato, NO 3 -
- Contestar
-
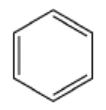
Todos los enlaces en benceno (abajo) tienen la misma distancia de enlace (1.39 A). Demuestre por qué esto es cierto.
- Contestar

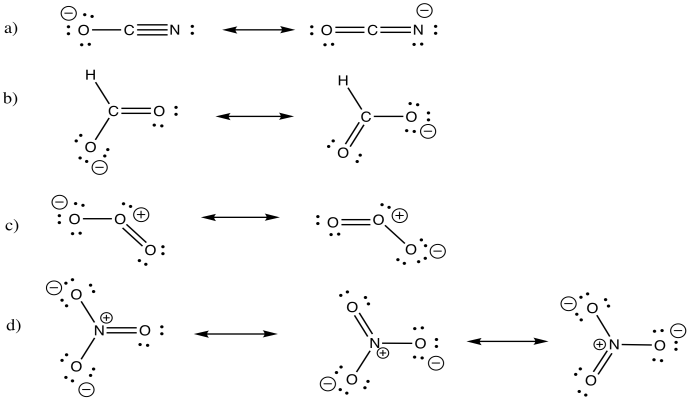
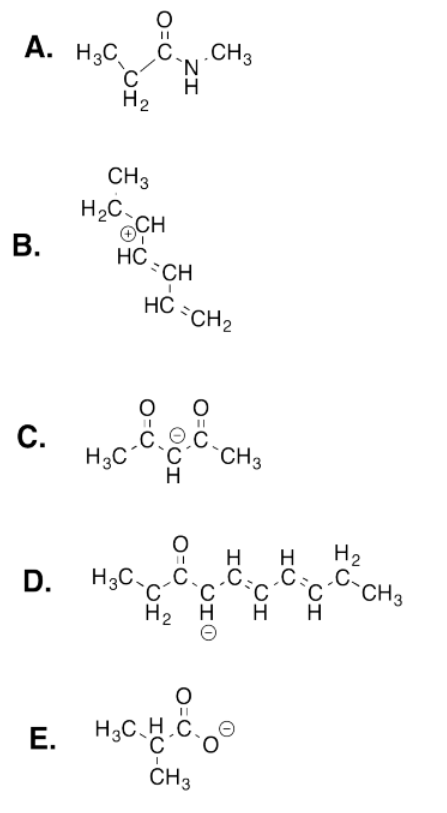
Existen varias estructuras de resonancia para cada uno de los siguientes iones. Mostrar al menos tres para cada uno.
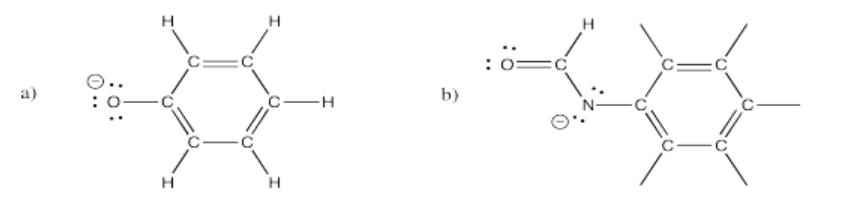
- Contestar
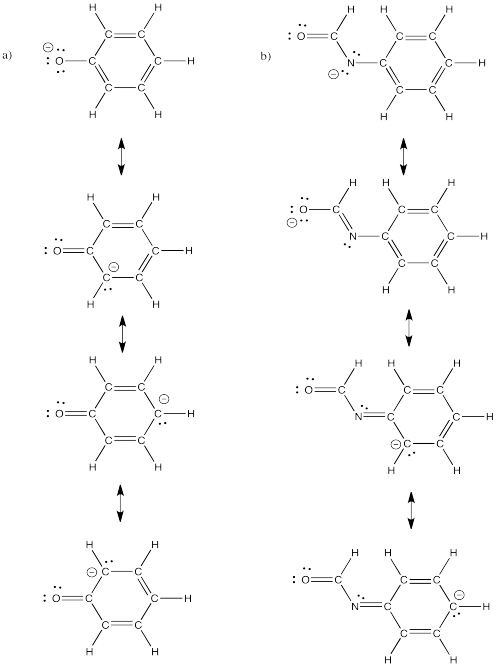
Problema IM6.4.
Los iones pueden estabilizarse en gran medida por deslocalización. Es decir, si una carga se puede extender sobre varios átomos por resonancia, la carga es más estable. Usa esta idea para predecir las estabilidades relativas de los siguientes iones (clasificarlos de los más estables a los menos estables).
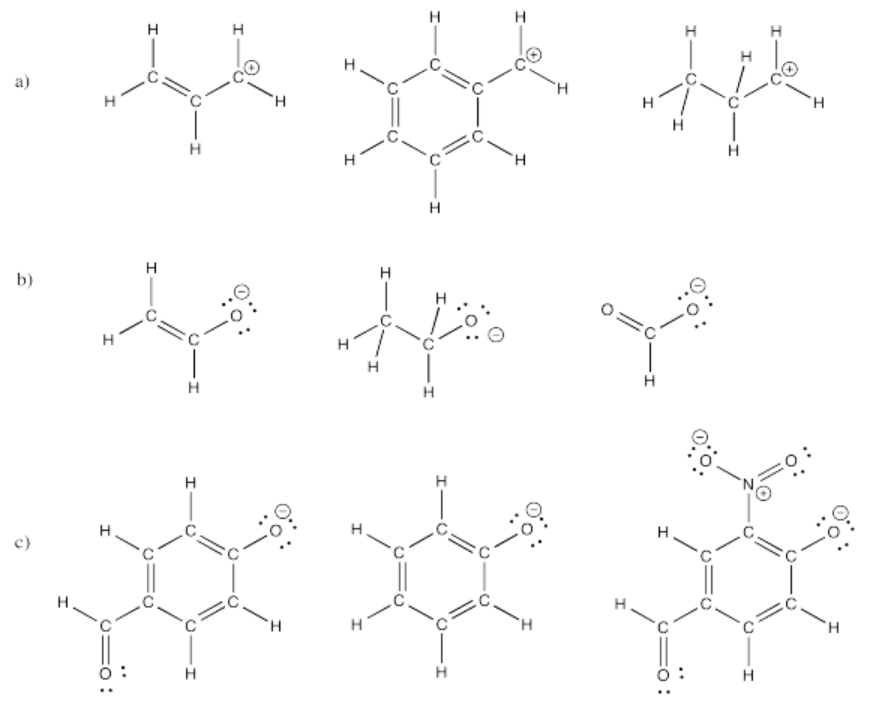
- Contestar
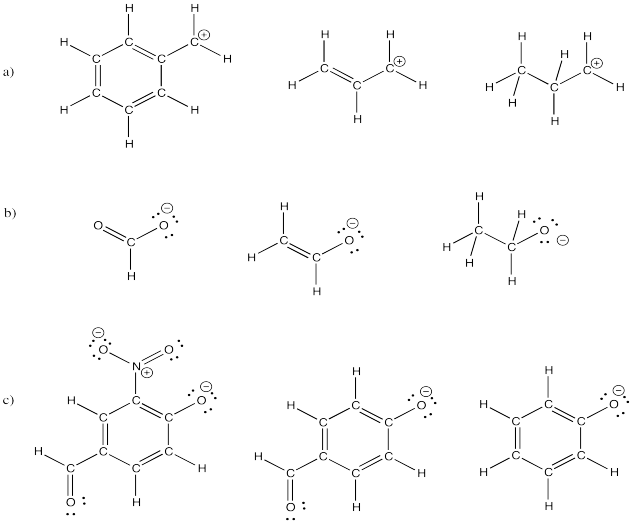
Dibujar estructuras de resonancia para las siguientes moléculas.
- Contestar