4.5: Lewis y el cargo formal
- Page ID
- 80587
Mirar la estructura de una molécula puede ayudarnos a comprender o predecir el comportamiento de ese compuesto. Una de las herramientas que eventualmente usaremos para entender la reactividad es la carga formal. Eso se debe a que la reactividad tiene que ver con la reorganización de electrones entre átomos. Nuevos enlaces químicos se forman compartiendo electrones. Los viejos enlaces químicos se rompen cuando un átomo toma los electrones de enlace lejos de otro átomo.
- reacciones químicas ocurren a través de la atracción y donación de electrones
La carga formal puede ayudarnos a entender el comportamiento del monóxido de carbono, CO. Cuando se expone a cationes de metales de transición como el hierro en la hemoglobina (Fe2+), el carbono es atraído y se une al metal. En el caso de la hemoglobina, debido a que el monóxido de carbono se une muy fuertemente al hierro, el CO bloquea la posición donde normalmente se uniría el oxígeno y resulta envenenamiento por monóxido de carbono.
- la carga formal puede ayudarnos a predecir cómo se comporta una molécula
- átomos con cargas formales positivas a menudo atraen electrones
- átomos con cargas formales negativas a menudo donan electrones
¿Por qué la molécula se comporta de esta manera? En realidad hay una serie de razones. Sin embargo, el hecho de que el carbono sea atraído por un catión metálico plantea la pregunta: ¿Es el carbono un anión? Sí, en cierto sentido. En una estructura de Lewis del compuesto, el carbono tiene una carga negativa formal. Verás por qué a continuación.
Los cargos formales son un importante dispositivo de contabilidad que utilizamos en las estructuras de Lewis. Nos dicen si un átomo está donando electrones extra a otro para darle un octeto. Si un átomo necesita donar más electrones de lo normal para que todos obtengan un octeto, tendrá una carga formal positiva. Si un átomo dona menos electrones de lo normal y todos todavía tienen un octeto, debe estar obteniendo electrones extra de otro lugar. Tendrá un cargo formal negativo.
- carga formal suele estar presente si el átomo no tiene su número habitual de enlaces
- las reglas de valencia pueden actuar como banderas para alertarte de que hay cargos formales
Para ayudarnos a pensar en los cargos formales, veamos algunas moléculas pequeñas que contienen enlaces múltiples carbono-oxígeno pero que son ligeramente diferentes entre sí. Formaldehído (CH 2 O) es un químico que se utiliza para preservar los tejidos; puede estar familiarizado con su olor del laboratorio de anatomía. El monóxido de carbono es el resultado de la quema de combustibles fósiles; también es un importante químico industrial utilizado en la fabricación de detergentes. El carbonato es un anión que se encuentra en muchas formas. El carbonato de calcio se encuentra en la piedra caliza y la tiza, por ejemplo.
Mira la estructura del formaldehído. El oxígeno tiene una valencia normal de dos, y tiene dos enlaces en formaldehído, por lo que no hay carga formal sobre el oxígeno. El carbono tiene una valencia normal de cuatro, y aquí tiene cuatro enlaces. No hay ningún cargo formal sobre el carbono. Tampoco hay cargos formales sobre los hidrógenos.
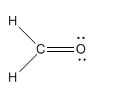
El monóxido de carbono tiene una estructura que es muy similar al formaldehído. Sin embargo, no tiene hidrógenos. Con diez electrones en total, la única manera de obtener un octeto en ambos átomos es hacer tres enlaces entre carbono y oxígeno.
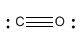
El oxígeno tiene valencia normal dos, pero aquí está haciendo tres enlaces. Está compartiendo un par extra de sus electrones con el carbono para hacer ese tercer enlace. Si está compartiendo un par de electrones, podemos pensar en ello guardando uno para sí mismo y dando el otro al carbono. Ya que le da uno de sus electrones al carbono, tiene carga formal +1.
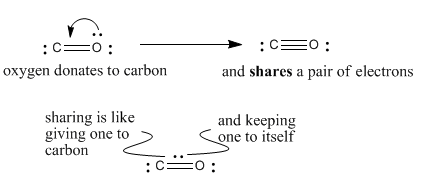
El carbono tiene valencia normal cuatro, pero aquí sólo está haciendo tres enlaces, a pesar de que tiene un octeto. ¿Cómo consiguió un octeto con sólo tres lazos? Obtuvo un electrón extra de alguna parte (el oxígeno). Tiene cargo formal -1.
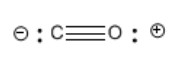
Observe que en general la molécula de monóxido de carbono es neutra. El oxígeno tiene una carga positiva y el carbono tiene una carga negativa. Estos cargos se cancelan para dar una molécula neutra global.
Lo que realmente estamos haciendo cuando asignamos carga formal es comparar cuántos electrones trajo el átomo de la tabla periódica con cuántos tiene ahora. Si el átomo trajo cuatro electrones propios y ahora comparte ocho, las cosas son parejos. Trajo cuatro para compartir y consiguió cuatro de sus vecinos en un comercio parejo. Si solo trajo tres propios y ahora comparte ocho, obtuvo más electrones de los que dio, y tendrá una carga negativa.
Para determinar el cargo formal:
- verificar el número de electrones en el átomo en la tabla periódica
- verificar el número de electrones enteramente propiedad del átomo en la molécula; esto es diferente a buscar un octeto
- Los electrones “enteramente poseídos” incluyen cualquier electrón en pares solitarios, ya que pertenecen completamente a un átomo
- Los electrones “enteramente poseídos” también incluyen la mitad de los electrones en los enlaces al átomo, ya que está compartiendo cada uno de esos pares con otros átomos.
Comparar el número de electrones de valencia enteramente poseídos en la tabla periódica con los enteramente propiedad del átomo en la molécula.
- si el número de electrones enteramente poseídos en el átomo en la molécula es mayor que en la tabla periódica, el átomo tiene una carga negativa
- si el número de electrones enteramente poseídos en el átomo en la molécula es menor que en la tabla periódica, el átomo tiene una carga positiva
- la carga formal es aditiva: si el átomo tiene dos electrones extra en la molécula, tiene una carga de dos menos. Si es dos cortos, tiene un cargo de dos plus.
Recuerde, el conteo de electrones para determinar un octeto cuenta todos los electrones de unión y no unión por igual. Se hace simplemente para determinar si el átomo tiene una configuración de gas noble en este momento. El conteo de electrones para determinar la carga formal se realiza para realizar un seguimiento de quién le ha dado electrones a quién al hacer la molécula. Si, al llegar a un octeto, los átomos han recibido más electrones de los que han dado, su relación electrón/protón ha cambiado, y se cargan.
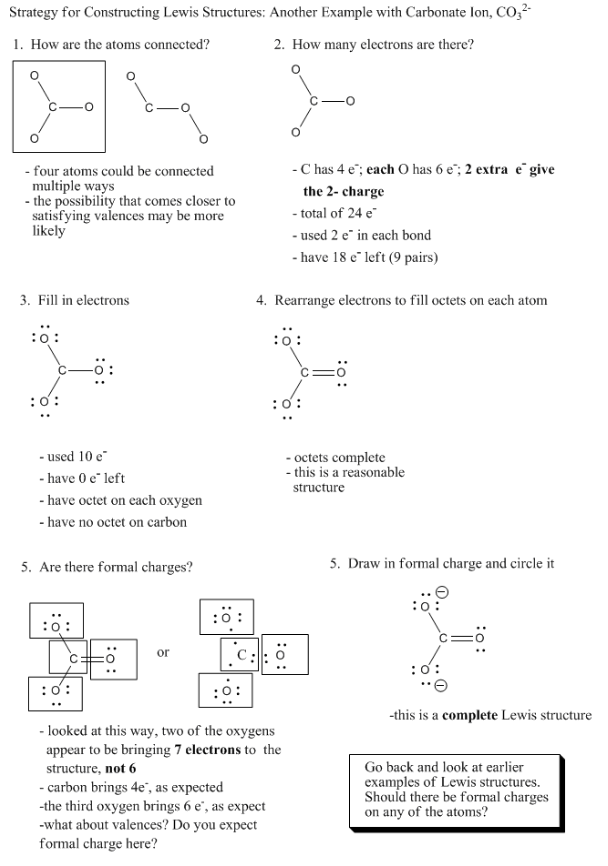
Dibuje estructuras de Lewis o Kekule para las siguientes moléculas, recordando incluir cargas formales, si las hubiera (y observe que algunas de estas moléculas son iones):
a) NO + b) CN - c) CH 3 O - d) CH 3 + e) HNO 3 f) CH 3 CO 2 -
- Responder
-
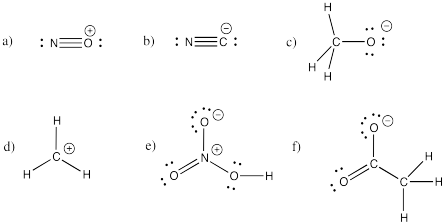
Dadas las estructuras a continuación, asigne los cargos formales faltantes.
- Responder
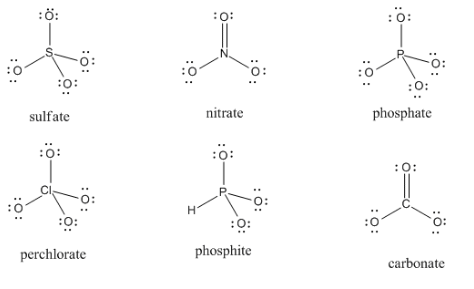
RespuestaEjercicio 4.5.2. De izquierda a derecha, de arriba a abajo: fórmulas estructurales para sulfato, nitrato, fosfato, perclorato, fosfito y carbonato.
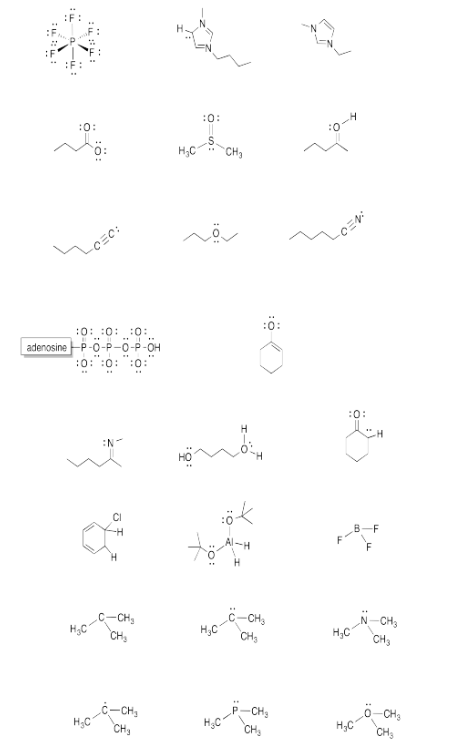
Dadas las estructuras de abajo, dibuje los electrones faltantes, si los hubiera.
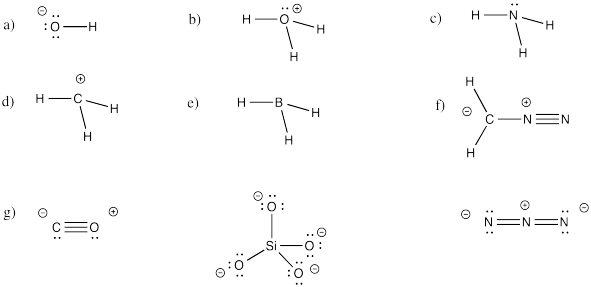
- Responder
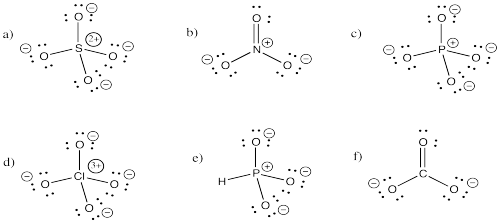
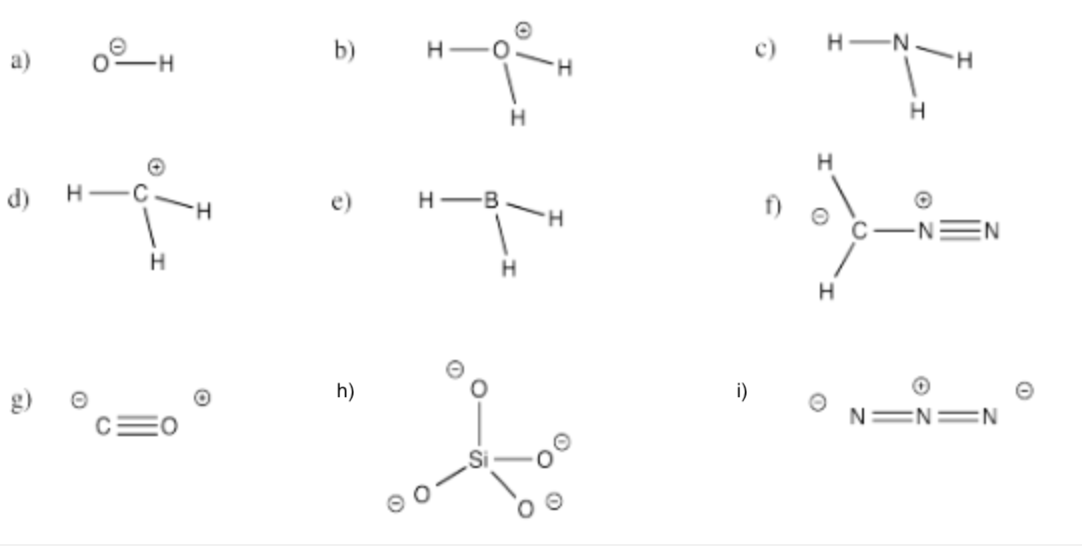
Marque todos los átomos en los siguientes compuestos con la carga formal correcta distinta de cero.
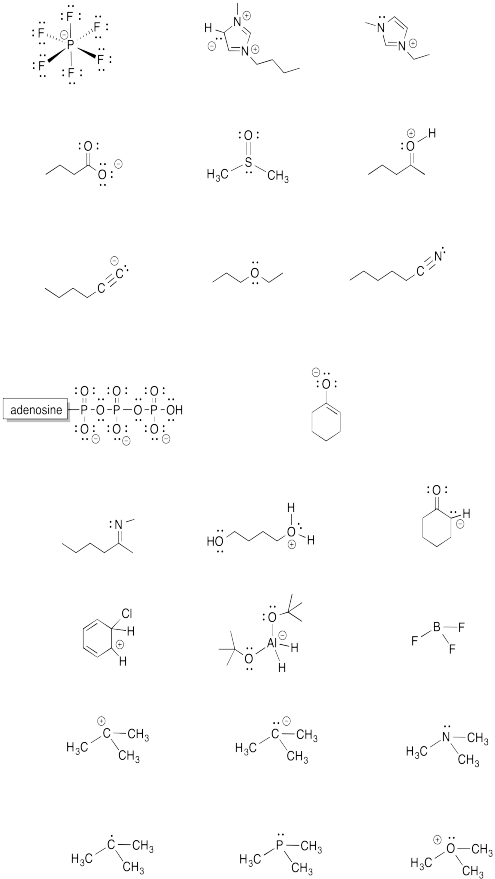
- Responder
Proporcionar estructuras para los siguientes oxoaniones (aniones con oxígenos unidos a otro átomo) de cloro:
a) hipoclorito, ClO - b) clorito, ClO 2 - c) clorato, ClO 3 - d) perclorato, ClO 4
Proporcionar estructuras para los siguientes oxoaniones de azufre:
a) sulfito, SO 3 2 - b) sulfato, SO 4 2 - c) tiosulfato, S 2 O 3 2 -
d) disulfato, S 2 O 7 2 - e) persulfato o peroxomonosulfato, SO 5 2 -
Proporcionar estructuras para los siguientes oxoaniones de fósforo:
a) fosfato, PO 4 3 - b) fosfito, HPO 3 2 - c) hipofosfito, H 2 PO 2 -
Tenga en cuenta que los átomos de hidrógeno en algunos oxoaniones de fósforo están unidos al átomo de fósforo.

