4.8: Dibujos de líneas
- Page ID
- 80583
Dibujos de líneas
Las estructuras de Lewis pueden decirnos mucho sobre cómo los átomos se unen para hacer moléculas. También pueden ser engorrosos, sobre todo si estamos tratando con moléculas muy grandes. Dibujar una línea en lugar de un par de puntos para unir pares de electrones hace que sea más fácil dibujar estructuras. Hay otras abreviaturas que son útiles en algunas situaciones.
Debido a que la química orgánica se basa en los compuestos del carbono, tendríamos que dibujar la letra C una y otra vez a menos que tuviéramos un atajo. En las estructuras lineales, dejamos caer la etiqueta “C” para los átomos de carbono. Cada vez que hay una unión entre dos enlaces (dibujado como un vértice en una línea en zig-zag), se supone que el átomo unido a ese enlace es un carbono a menos que se escriba lo contrario.
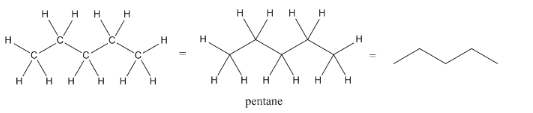
El átomo al final de una línea en zig-zag también sería un carbono, a menos que esté escrito explícitamente como otro átomo.
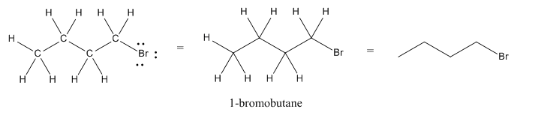
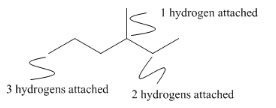
Tomados aún más lejos, omitiremos los hidrógenos de nuestras estructuras, ya que los compuestos de carbono casi siempre contienen hidrógeno también. Como sabemos que el carbono tiene una valencia de cuatro, siempre sabemos cuántos átomos de hidrógeno están unidos a cada carbono para llegar a esa valencia. Un carbono con dos enlaces arrastrados debe tener dos hidrógenos en él. Un carbono con un solo enlace atraído a él debe tener tres hidrógenos.
Obsérvese que los hidrógenos normalmente no se omiten si están unidos a heteroátomos (átomos distintos al carbono, como el oxígeno o el nitrógeno).
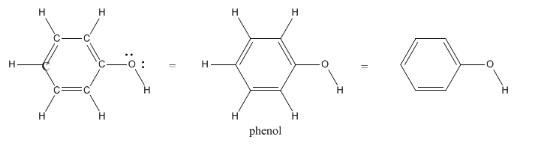
También notarás que los pares solitarios suelen quedar fuera cuando usamos estructuras de líneas, por lo que tendrás que volver a agregarlos para pensar en las estructuras de Lewis. Agregar los pares solitarios de nuevo a los heteroátomos en las estructuras lineales es un buen hábito para entrar, porque más adelante en el curso estaremos muy preocupados por hacer un seguimiento de dónde están todos los electrones.
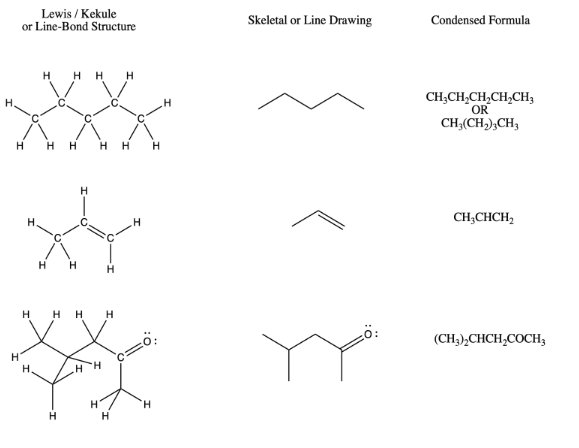
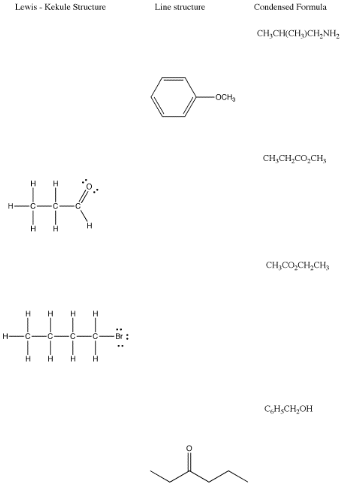
A continuación se muestra un resumen, que muestra la relación entre las estructuras de Lewis/Kekule, las estructuras lineales y las fórmulas condensadas para algunos compuestos diferentes.
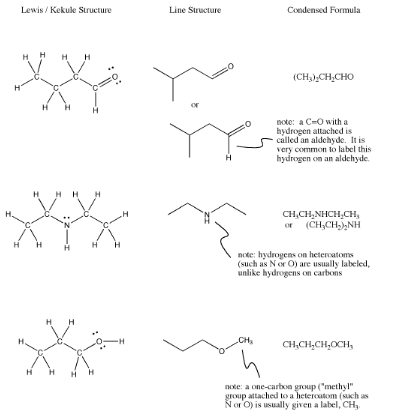
Recuerde, en fenol, el hidrógeno unido al oxígeno se etiquetó en la estructura lineal. A veces hay excepciones en las estructuras de líneas, en las que los átomos que tal vez no se piense en etiquetar suelen obtener etiquetas. A continuación se muestran las excepciones más comunes.
Traduzca las siguientes fórmulas condensadas en dibujos lineales.
a) CH 3 CH 2 NHCH 2 CH 3 b) CH 3 CHFCH 2 CH 2 CH 2 Cl
c) CH 2 CHOCH 2 CH 3 d) CH 3 CHClCH 2 SCH 2 CH 3
- Contestar
-
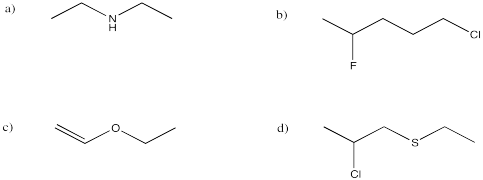
Traducir las siguientes estructuras en fórmula condensada.
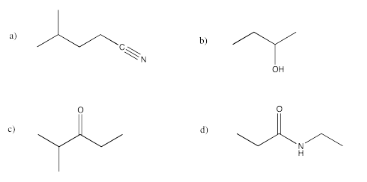
- Contestar a
- Respuesta b
- Respuesta c
- Respuesta d
Responder a (CH3) 2CHCH2CH2cnResponder bCH3CH2Ch (OH) CH3Respuesta c (CH3) 2CHCoCH2CH3Respuesta DCH3CH2conHCH2CH3
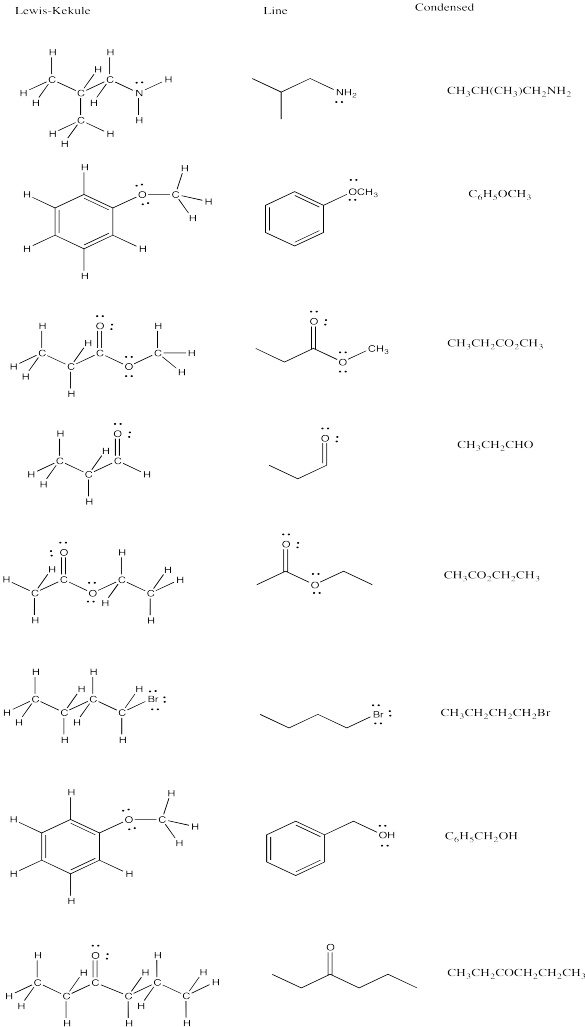
Intente rellenar el dibujo lineal faltante, las estructuras Lewis/Kekule o las fórmulas condensadas en cada línea de la tabla a continuación.
- Contestar
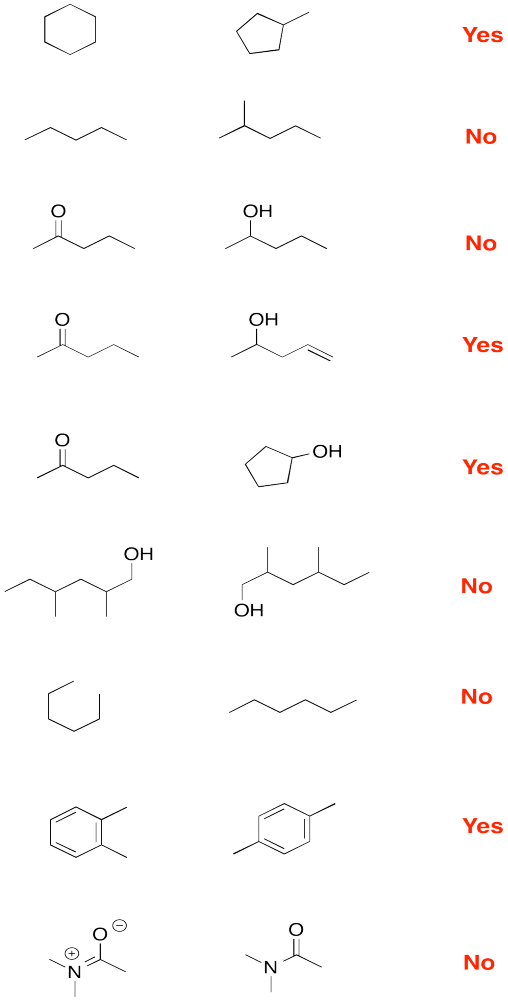
Mira los siguientes pares de compuestos. ¿Los compuestos son isómeros constitucionales? (Pista: Es posible que deba agregar todos los hidrógenos)
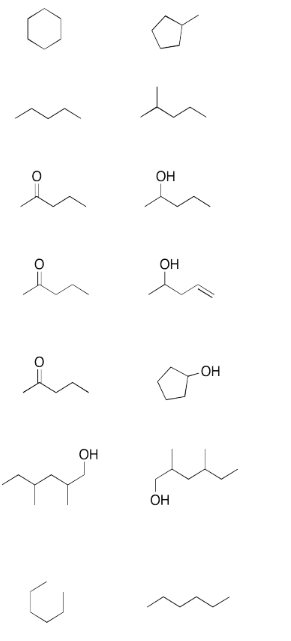
- Contestar