4.16: Soluciones a Problemas Seleccionados
- Page ID
- 80588
Ejercicio 4.1.1:
Ejercicio 4.1.2
Ejercicio 4.2.1:

Ejercicio 4.2.2
Ejercicio 4.3.1
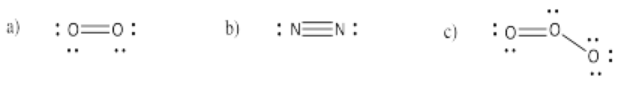
Ejercicio 4.3.2:
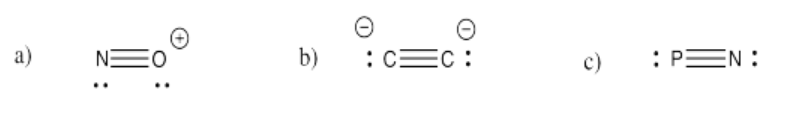
Ejercicio 4.3.3:

Ejercicio 4.4.1:
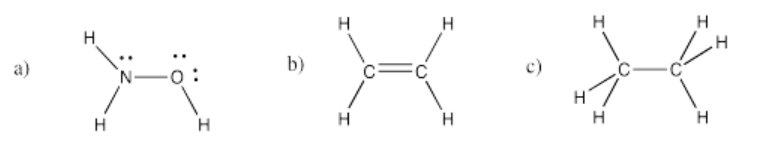
Ejercicio 4.4.2:
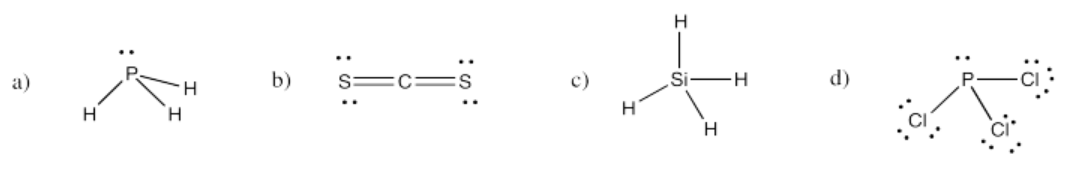
Ejercicio 4.4.3:
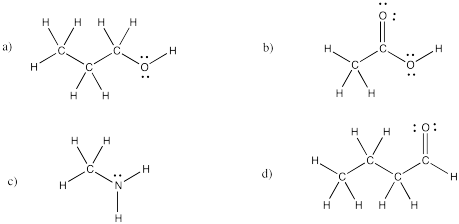
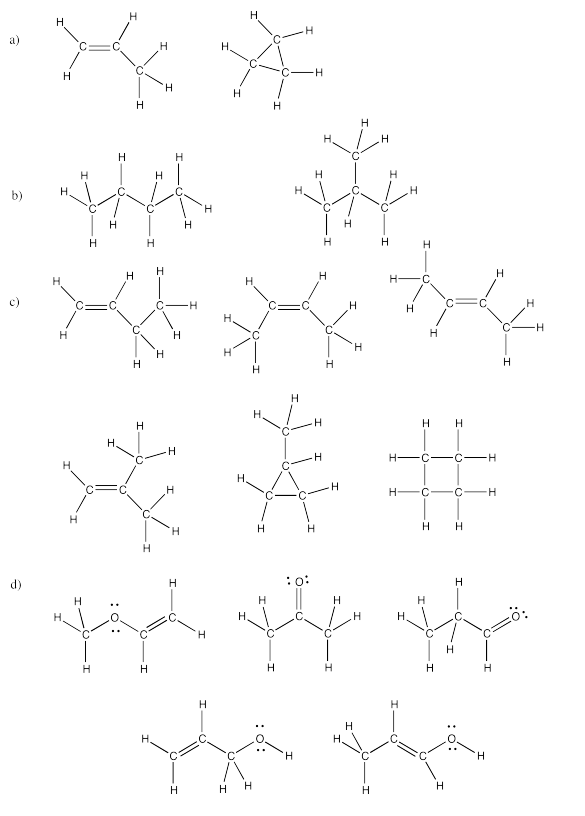

Ejercicio 4.4.5
Ejercicio 4.5.1:
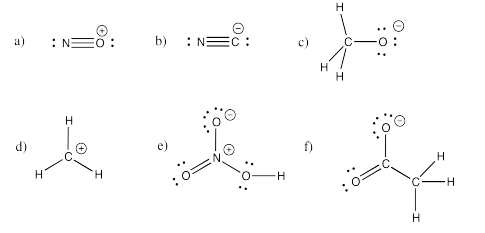
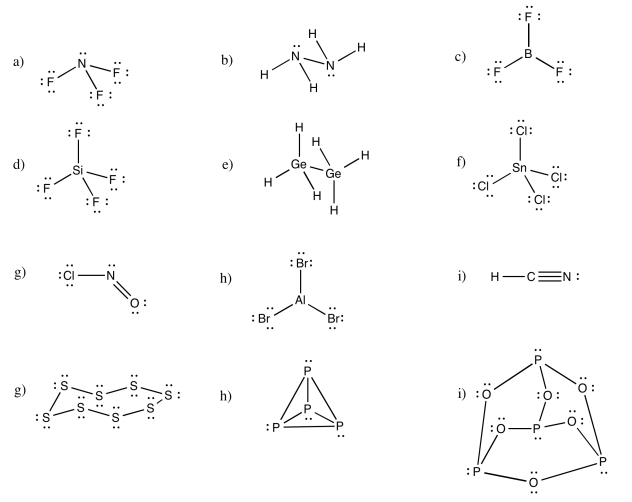
Ejercicio 4.5.2:
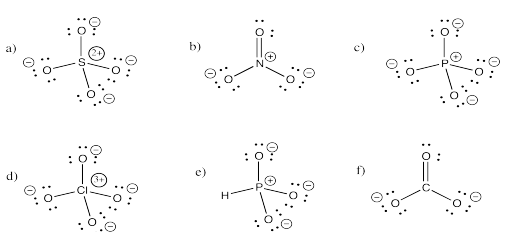
Ejercicio 4.5.3:
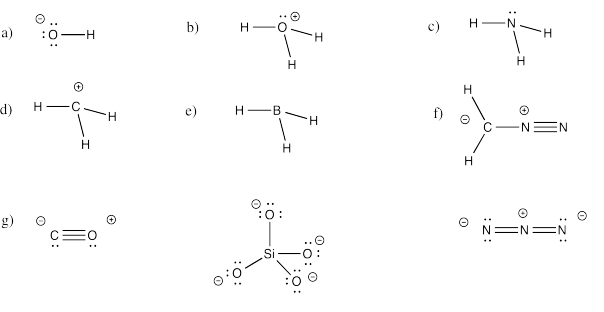
Ejercicio 4.5.4:
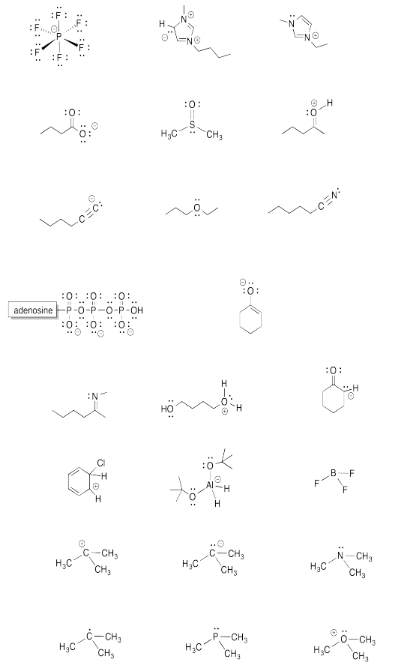
Ejercicio 4.6.1:
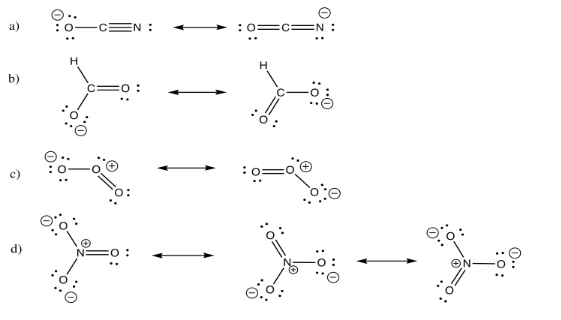
Ejercicio 4.6.2:
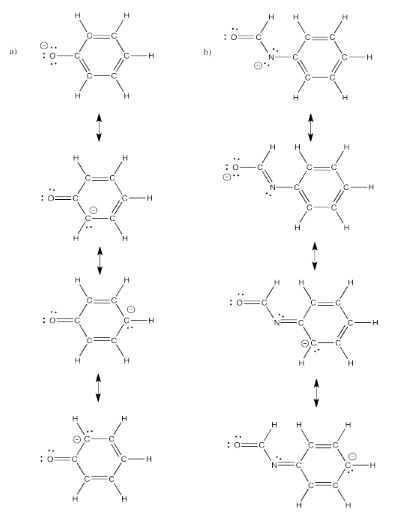
Ejercicio 4.6.3:
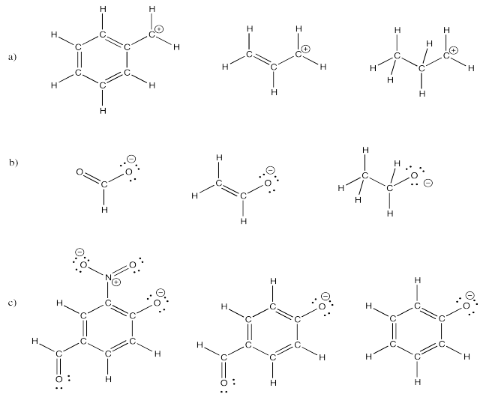
Ejercicio 4.6.4:

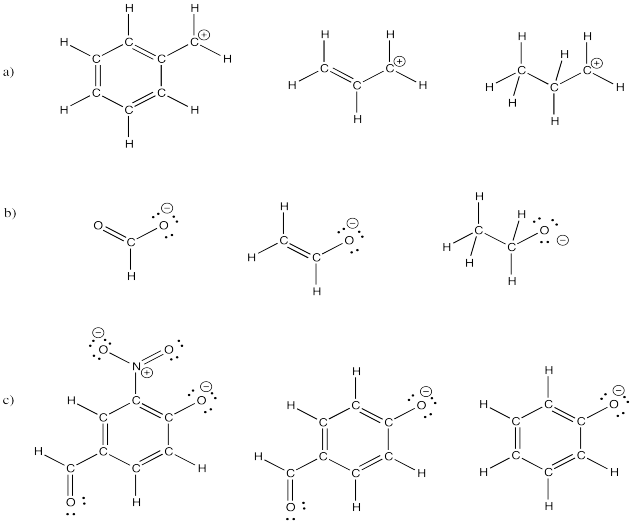
Ejercicio 4.6.5:
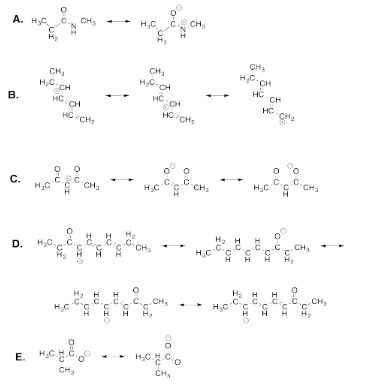
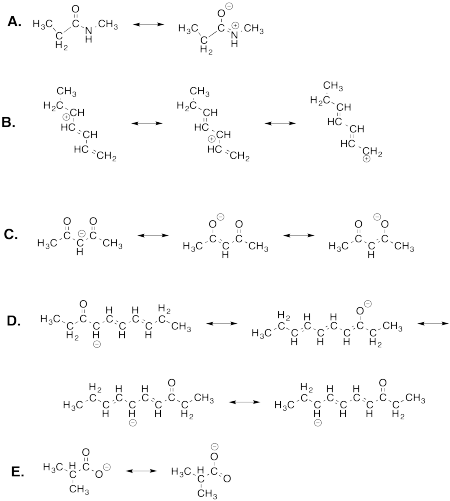
Ejercicio 4.7.1:
Ejercicio 4.7.2:
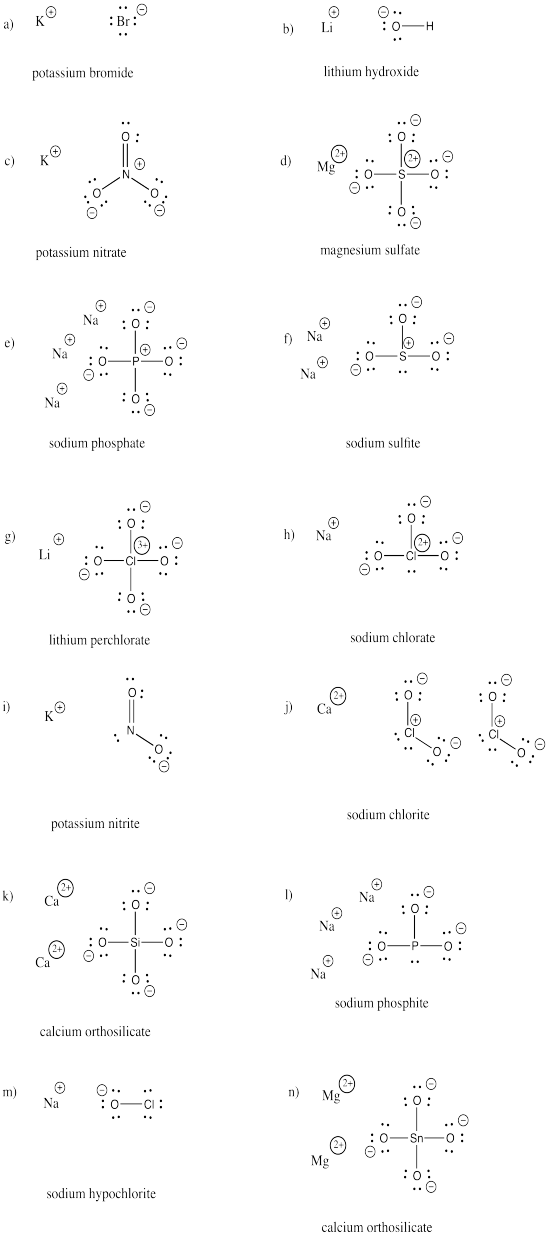
Ejercicio 4.7.3:

Ejercicio 4.7.4:
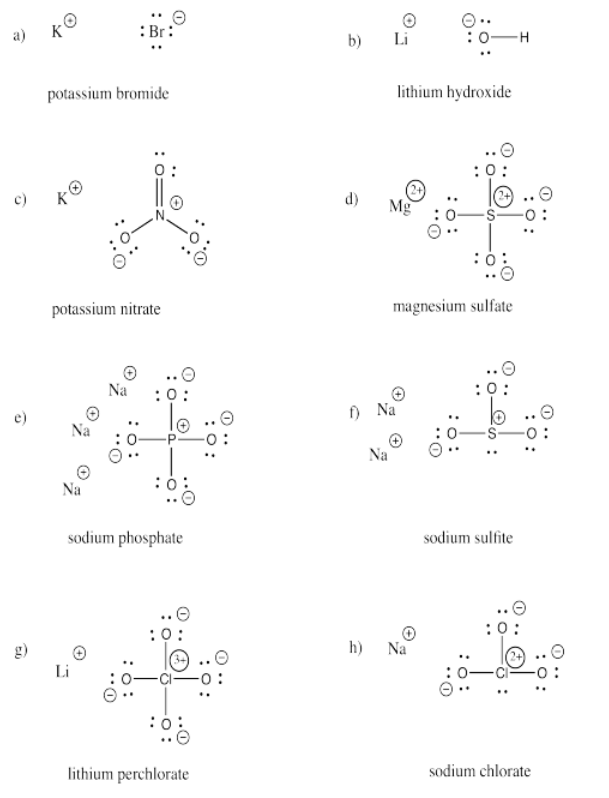
a) bromuro b) óxido c) fluoruro d) carbonato e) nitrato f) nitrito
g) sulfuro h) sulfato i) sulfito j) persulfato k) carburo l) nitruro m) arseniuro
n) fosfato o) fosfito p) yoduro q) yodato r) peryodato
Ejercicio 4.8.1:
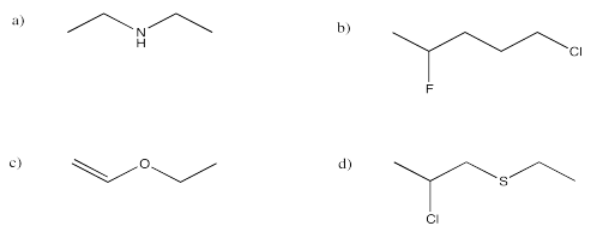
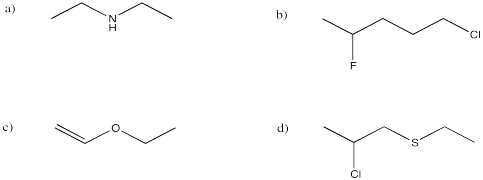
Ejercicio 4.8.2:
a) (CH 3) 2 CHCH 2 CH 2 CN b) CH 3 CH 2 CH (OH) CH 3
c) (CH 3) 2 CHCOCH 2 CH 3 d) CH 3 CH 2 CONHCH 2 CH 3
Ejercicio 4.8.3:
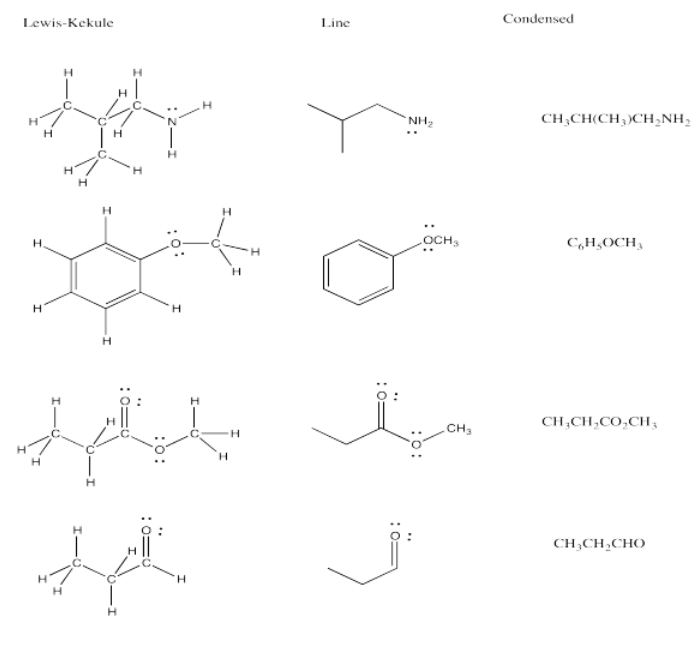
Ejercicio 4.8.4:

Ejercicio 4.9.1:
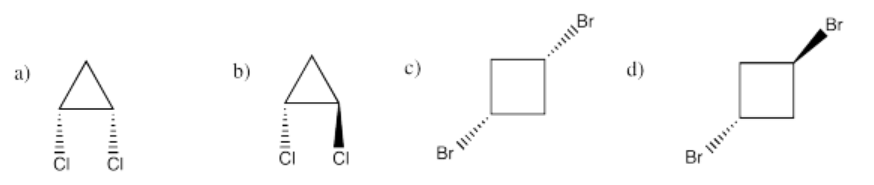
Ejercicio 4.9.2:
Ejercicio 4.10.1:
a) octaédrica.
b)
c)
Ejercicio 4.10.2:
- bipiramidal trigonal
- Esta vez podría haber dos respuestas distintas.
Si el par solitario ocupa una de las posiciones axiales, estaría bastante cerca de otros tres átomos.
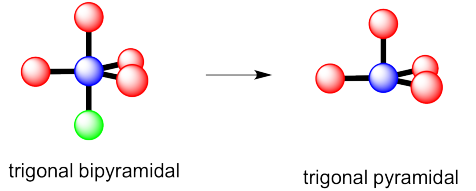
Si los pares solitarios ocupan una de las posiciones ecuatoriales, estaría bastante cerca de sólo otros dos átomos. Los otros átomos ecuatoriales están bastante lejos.
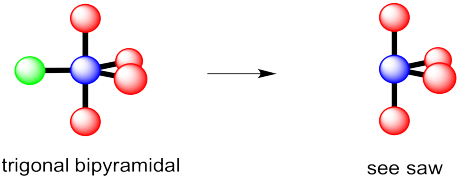
La regla es que la pareja solitaria va en la posición menos concurrida, por lo que esta molécula tendría forma de sierra.
c) Nuevamente, hay dos geometrías posibles. Uno de ellos sería plano trigonal, una geometría bastante común.
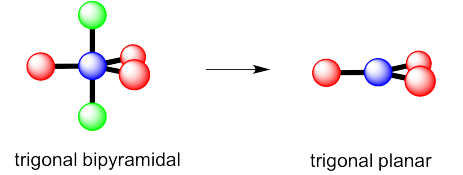
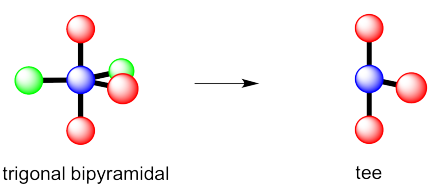
Ejercicio 4.10.3:
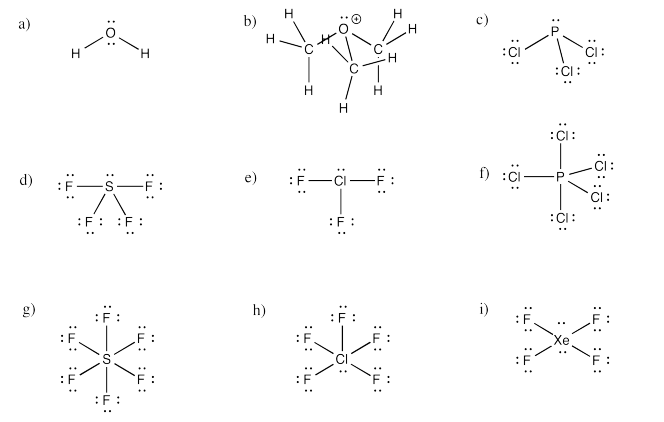
Ejercicio 4.10.4
a) doblado b) piramidal en O, aunque tetraédrico en C c) piramidal
d) sierras e) tee f) bipiramidal trigonal
g) octaédrico h) cuadrado piramidal i) plano cuadrado
Ejercicio 4.10.5:
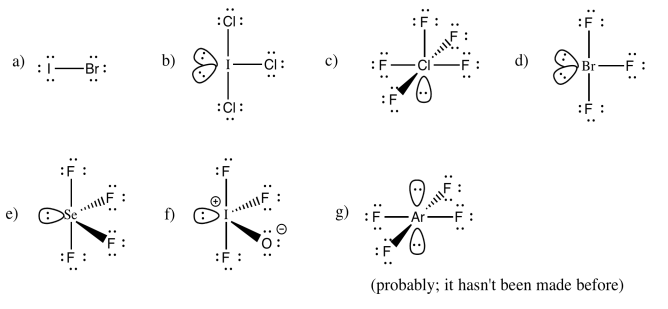
Ejercicio 4.10.6:
Es posible que puedas imaginar algunas otras posibilidades para este número de vecinos, pero IF 7 adopta una forma bipiramidal pentagonal.
Ejercicio 4.11.1:
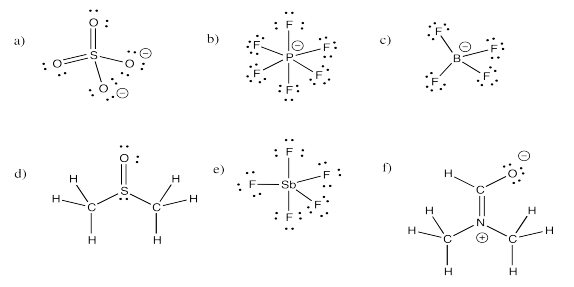
Ejercicio 4.11.2:
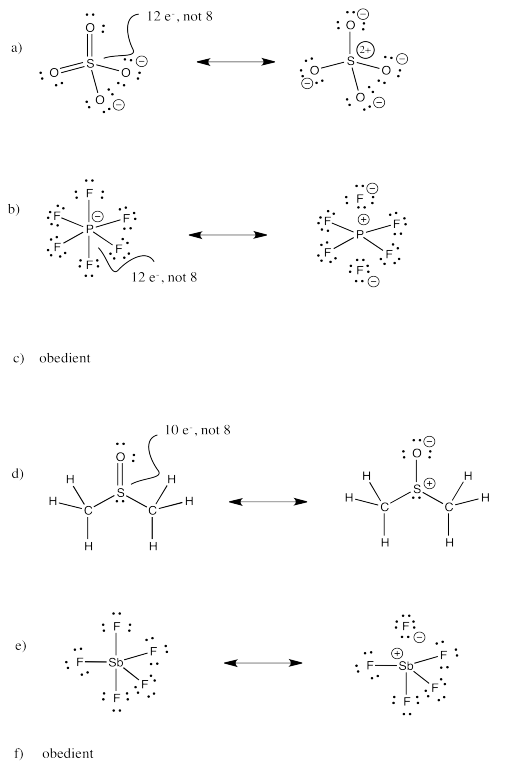
Ejercicio 4.11.3:
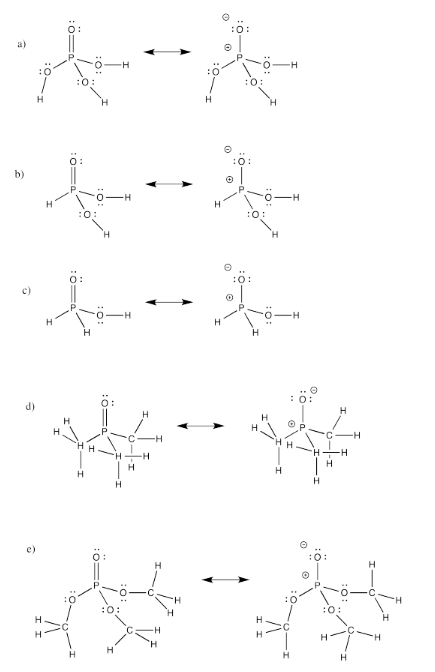
Ejercicio 4.12.2:
a) propano b) pentano c) hexano
Ejercicio 4.12.3:
a) 3-metilhexano b) 2,2-dimetilpentano c) 2,3-dimetilbutano
d) 2,2,3,3-tetrametilpentano e) 3,5-dimetilheptano f) 4-etil-3,6-dimetiloctano
Ejercicio 4.12.4
a) ciclopentano b) ciclohexano c) ciclooctano
d) metilciclobutano e) 1,1,3-trimetilciclopentano f) 1,3-dimetilcicloheptano
Ejercicio 4.12.5:
a) 1-hexeno b) 2-metil-2-penteno c) 1-metilciclohexeno d) 2,4,6-trimetil-2-hepteno
Ejercicio 4.12.6:
a) ciclopenteno b) 1,1-dimetilciclohexano c) 3-hexino
d) 4-metilciclohexeno e) 1-hexino
Ejercicio 4.12.7:
a) tetraédrico b) plano trigonal c) lineal
Ejercicio 4.12.8:
a) metilbenceno b) propilbenceno c) 1,2-dimetilbenceno u o-dimetilbenceno (también o-xileno)
d) 1,3-dimetilbenceno o m-dimetilbenceno (también m-xileno) e) 1,4-dietilbenceno o p-dietilbenceno
f) 2-etil-1,4-dimetilbenceno
Ejercicio 4.12.9:
a) 2,2-dimetilhexanal b) 2-metilciclopentanona
c) 3-nonanona d) 2,4-dimetil-2-hexenal
Ejercicio 4.12.10:
a) propanoato de butilo b) N, N-dietilbutanamida
c) Ácido 6-metilheptanoico d) Ácido 4-pentenoico
Ejercicio 4.12.11:
a) 1-cloro-2-metilciclohexano b) ciclooctanol c) etil ciclopentil éter
d) N-propilciclohexilamina e), 5,5-dimetilheptan-2-ol f) 3-bromo-4,4-dimetiloctano
g) dibutilamina i) metil fenil éter (o anisol) j) etanotiol k) dietil tioéter
l) trietilfosfina m) butanitrilo n) nitrometano
Tenga en cuenta que a veces un número se ubica directamente frente al sufijo para el grupo al que se refiere.
Ejercicio 4.12.12
- benceno (o aromático), cetona y éter
- bromuro, amina y aldehído
- alcohol, tiol y éster
- tioéter, amida y alqueno
- alquino, alcohol y ácido carboxílico
Ejercicio 4.12.13
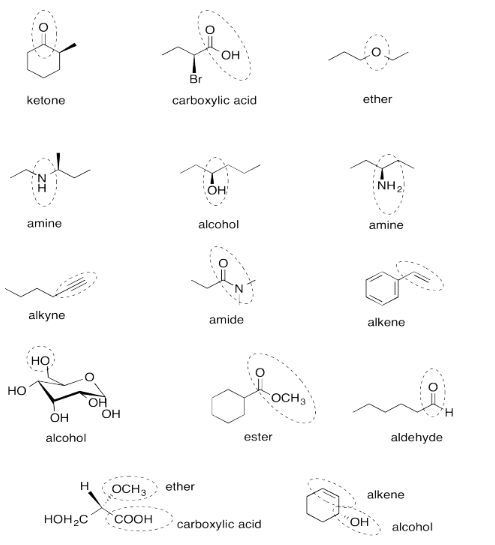
Ejercicio 4.12.14
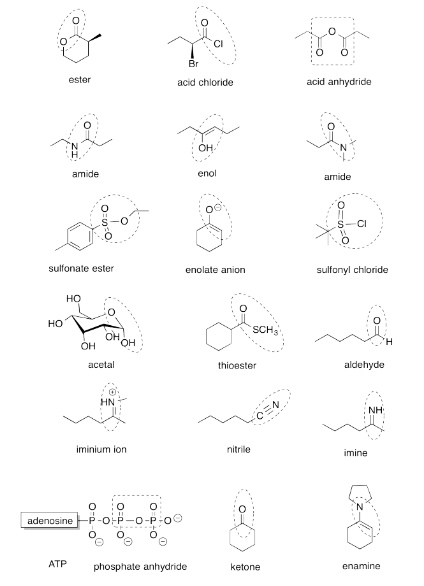
Ejercicio 4.13.1:
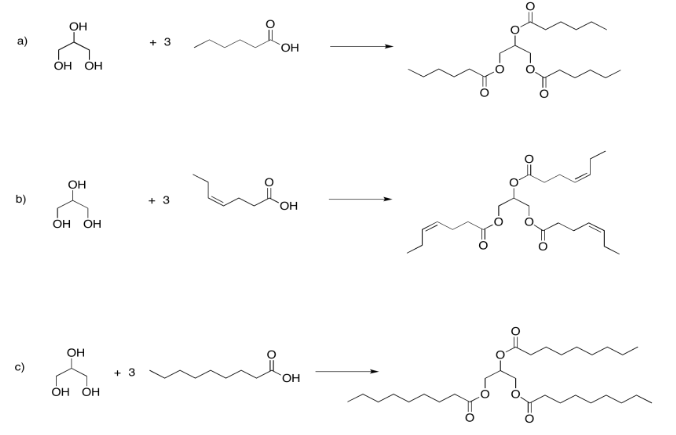
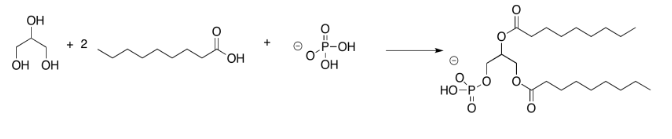
Ejercicio 4.13.4:
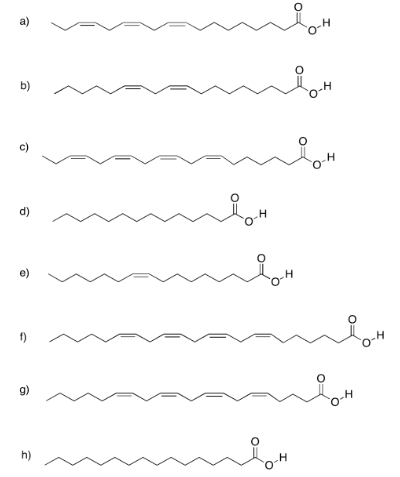
Ejercicio 4.13.5:
Si no sabes lo que significan las líneas acuñadas y discontinuas en el dibujo, no te preocupes por ello. Simplemente representan diferentes orientaciones en el espacio. Aprenderás sobre estas representaciones en un tema posterior llamado “estereoquímica”.
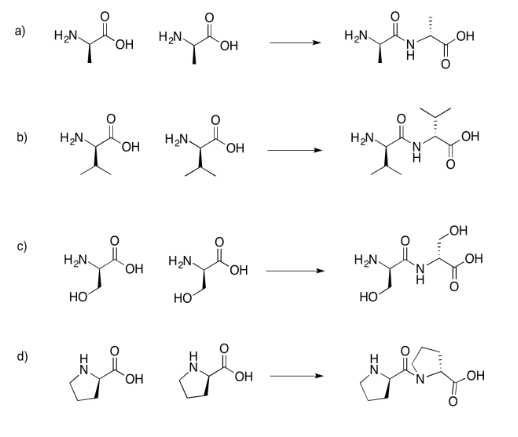
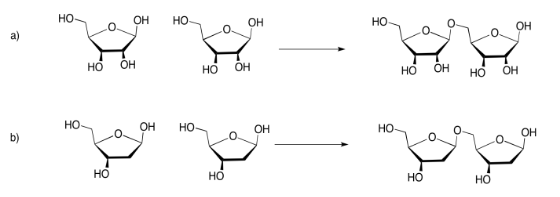
Ejercicio 4.13.6:
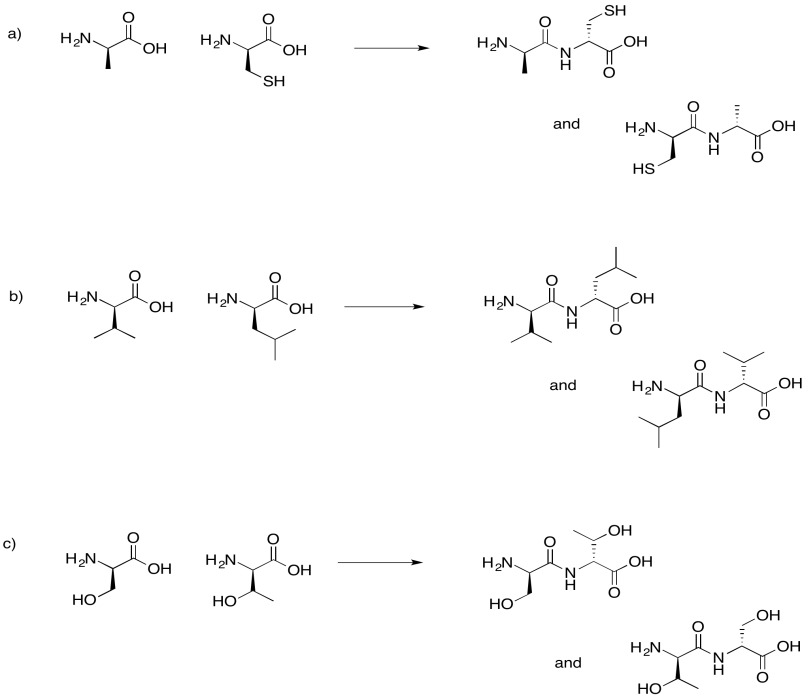
Ejercicio 4.13.7:
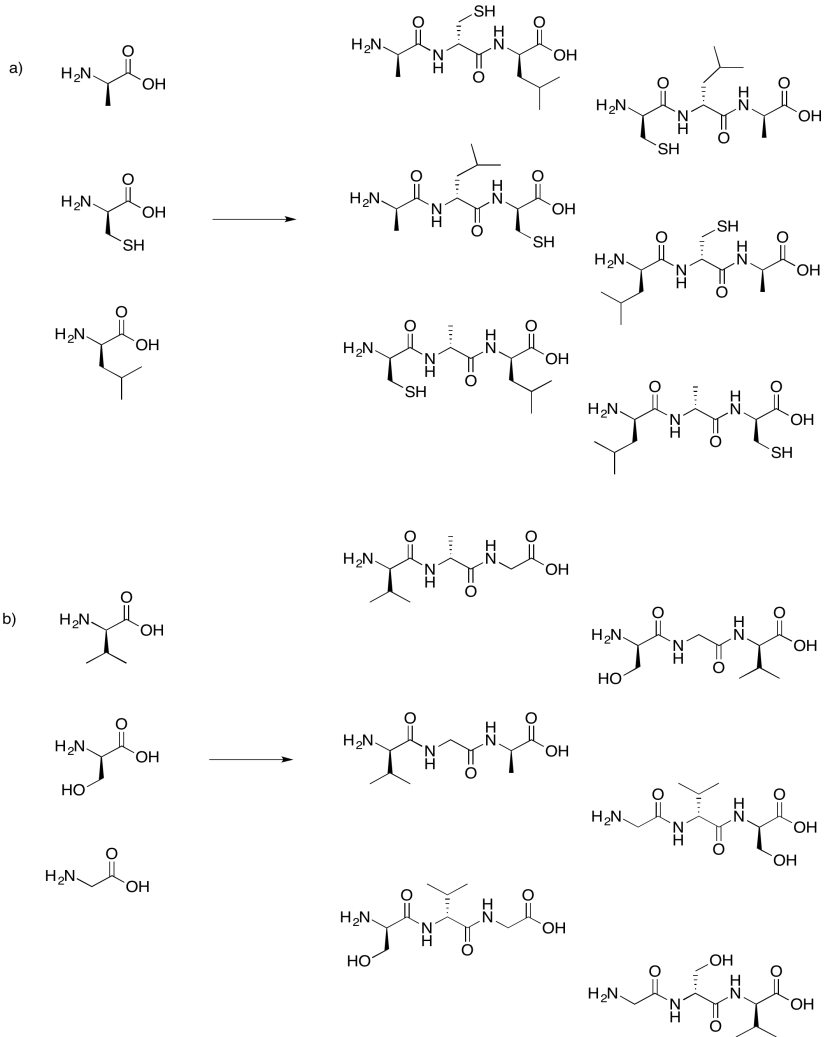
Ejercicio 4.13.8:
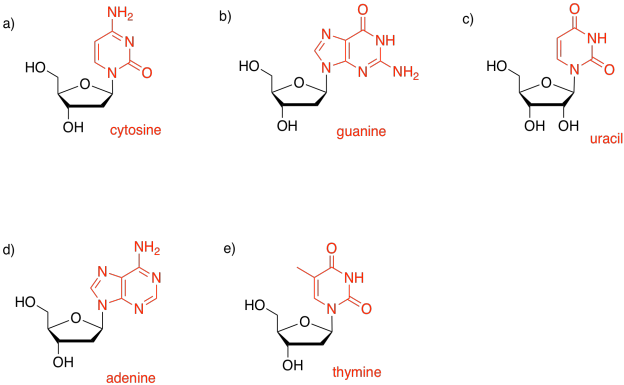
Ejercicio 4.15.1:
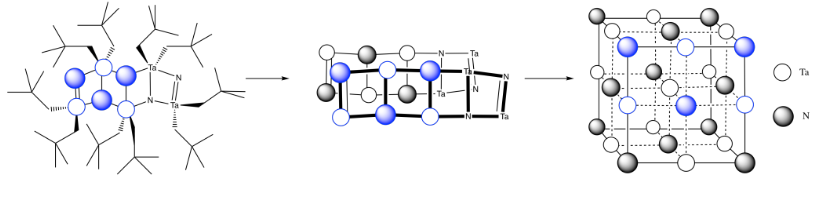
- N 3- llegaría a una configuración de gas noble.
- Ta 3 + equilibraría la carga en TaN.
c)
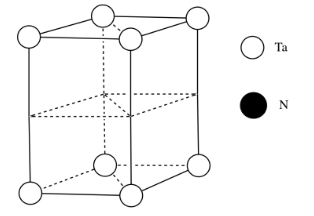
d)
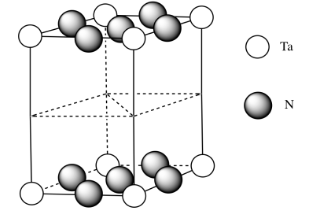
e)\( \# Ta = (\frac{1}{6})(\frac{1}{2})(4) \) para las esquinas agudas y\((\frac{1}{3})(\frac{1}{2})(4)\) para las esquinas obtusos =\(\frac{4}{12} + \frac{4}{6} = \frac{4}{12} + \frac{8}{12} =1\)
(tenga en cuenta que es el mismo resultado que las esquinas de un cubo)
f)\( \# N = \(\frac{1}{4})(8)\) para los bordes y\((\frac{1}{2})(2)\) para las caras =\( 2 + 1 =3\)
g) Necesita 2 Ta más.
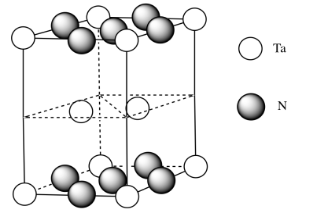
h) Cada tántalo tiene tres nitrógenos arriba y tres por debajo de él. Es casi octaédrica, pero la capa superior de nitrógenos se alinea por encima de la capa inferior en lugar de estar torcida 120 grados para formar un octaedro. La geometría es un prisma trigonal.
i)
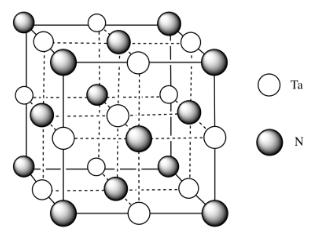
j)
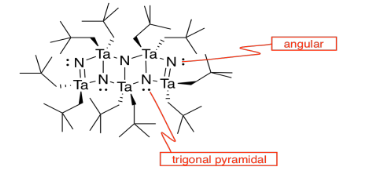
k)
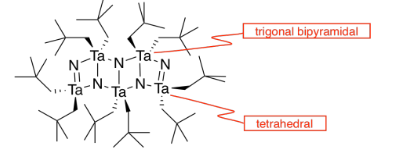
l) Los dobles enlaces mantienen los átomos más estrechamente juntos que los enlaces simples.
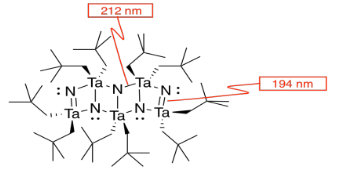
m) Se pueden imaginar las moléculas apilándose juntas para hacer una matriz cúbica de TaN.