6.2: Moléculas simples
- Page ID
- 80706
El eteno (CH 2 =CH 2) contiene dos átomos de carbono planos trigonales. Cada carbono está unido a dos hidrógenos así como al otro carbono.
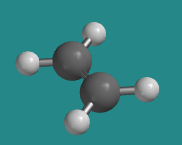
Esta estructura se ilustra en la animación Jmol enlazada a continuación. Estas animaciones son completamente manipulables con un ratón. (Son agarrables y móviles. Usa tu mouse.)
Ir a Animación CA2.1. Un modelo tridimensional de eteno.
Por consideraciones orbitales moleculares, los dos carbonos trigonales deben ser coplanares entre sí para maximizar el enlace carbono-carbono pi. Como resultado, toda la molécula debe ser plana.

El etano (CH 3 -CH 3) es muy similar al eteno, excepto que cada carbono es tetraédrico y está unido a tres átomos de hidrógeno. No es necesario disponer los dos átomos de carbono con una cierta orientación entre sí porque el enlace sigma que mantiene los dos carbonos juntos es simétrico alrededor del eje C-C. Como resultado, hay una serie de formas en que los dos extremos de las moléculas podrían orientarse.
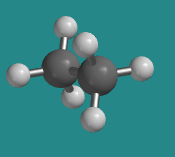
Ir a Animación CA2.2. Un modelo tridimensional de etano en conformador escalonado.
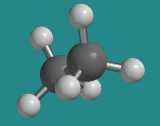
Ir a Animación CA2.3. Un modelo tridimensional de etano en conformación eclipsada.
Trabajar con modelos a menudo refleja bastante bien la realidad. Mientras sostenías un modelo de etano, podrías agarrar un grupo CH 3 y girarlo mientras sostienes el otro quieto, y como resultado podrías poner la molécula en diferentes poses. El modelo de etano es flexible a través de la rotación alrededor del enlace C-C.
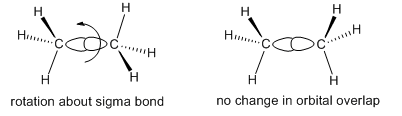
El etano puede adoptar diferentes formas, porque un extremo de la molécula puede rotar con respecto al otro. Estas diferentes formas se ven más dramáticamente mientras se ve etano a lo largo del enlace carbono-carbono. Desde este punto de vista, la rotación alrededor del enlace C-C resulta en una forma cambiante que alterna entre una estrella de seis puntas y una de tres puntas. En la estrella de tres puntas, algunos de los hidrógenos están ocultos o eclipsados detrás de los hidrógenos correspondientes sobre el carbono que está más cerca del espectador; en la estrella de seis puntas han vuelto a salir a la vista.
- Un dibujo que muestra una molécula vista a lo largo del eje de un enlace giratorio se llama Proyección Newman.
- Las diferentes formas obtenidas a través de la rotación de enlaces se denominan conformaciones.
- El ángulo entre un enlace C-H específico en un carbono y un enlace C-H específico en otro carbono, cuando se ve en una proyección de Newman, se denomina ángulo diedro.
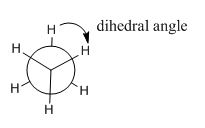
- La conformación en la que la proyección de Newman muestra los seis hidrógenos de etano a simple vista es una conformación escalonada.
- La conformación en la que tres de los hidrógenos se esconden detrás de los otros es una conformación eclipsada.
- En la conformación eclipsada, el ángulo diedro podría ser de 0, 120, 240 o 360 grados; en un conformador escalonado, el ángulo diedro podría ser de 60, 180, 300 grados.
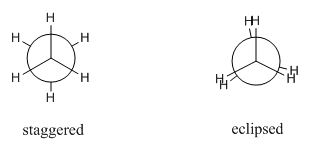
Muchas conformaciones de etano son posibles, pero no todas estas conformaciones son igualmente probables. La conformación más probable es la escalonada.
- Las conformaciones escalonadas son más bajas en energía que las eclipsadas.
- El término “conformador” se utiliza para una conformación estable, una que tiene una posibilidad práctica de ocurrir.
La barrera energética a la rotación alrededor del enlace C-C en una molécula de etano se puede medir mediante espectroscopía de microondas. Esta técnica es similar a la espectroscopia infrarroja, pero el movimiento molecular conectado a las microondas es la rotación de enlace en lugar de la vibración. Experimentalmente, la barrera a la rotación es de aproximadamente 3 kcal/mol. (Hay que tener en cuenta que, en química, el término “experimental” da un hallazgo más peso, no menos, porque refleja la realidad.) Esta barrera es lo suficientemente pequeña como para que a temperatura ambiente una molécula de etano pueda rotar libremente, pero lo suficientemente alta como para que no se encuentre una molécula de etano sentada en el estado eclipsado.
- El factor que desestabiliza las conformaciones eclipsadas se denomina deformación torsional.
- La deformación torsional en etano aparentemente surge de una interacción orbital molecular entre un enlace C-H σ poblado y el orbital C-H σ* vacío en el carbono vecino.
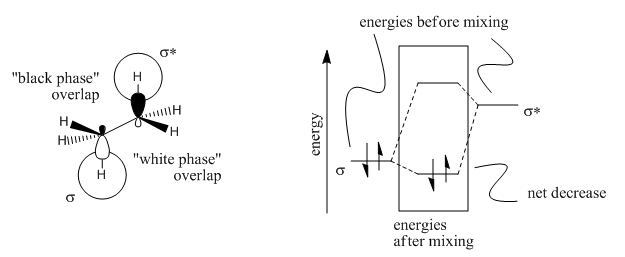
- Cuando los dos enlaces C-H están en el mismo plano pero apuntando en direcciones opuestas, los orbitales tienen la simetría adecuada para interactuar. A esto se le llama una orientación antiperiplanar, de anti, que significa “opuesta”, y periplanar, que significa “en el mismo plano”.
- Esta orientación solo es posible cuando los enlaces vecinos están escalonados.
- Las conformaciones eclipsadas carecen de esta interacción y son más altas en energía en aproximadamente 3 kcal/mol (aproximadamente 1 kcal/mol por interacción C-H σ - σ*.
Al observar un modelo de etano para llenar espacios, parece que la diferencia de forma general entre etano escalonado y eclipsado es bastante pequeña. El punto importante es que la mayoría de las estructuras orgánicas no son estáticas, sino flexibles. Además, la deformación torsional se encuentra en todos los enlaces carbono-carbono, por lo que seguiremos usando el resultado experimental del etano a medida que construimos un “conjunto de bases” para comprender la conformación en moléculas más grandes.
Fotos fijas de modelos obtenidos usando Spartan 14 de Wavefunction, Inc., Irvine, California.

